MUSCOLO SCHELETRICO, COMPOSIZIONE CORPOREA E ‘’HEALTHY AGING’’: DIETA, ATTIVITÀ FISICA E INTEGRAZIONE NUTRACEUTICA

L’invecchiamento è un processo fisiologico complesso che comporta profonde modificazioni della composizione corporea, influenzando in modo significativo la massa muscolare, la massa grassa e la densità ossea. La perdita progressiva di massa muscolare (in particolare a carico delle fibre di tipo II), se non adeguatamente contrastata, può portare allo sviluppo della sarcopenia: condizione età-dipendente caratterizzata dal declino della struttura e della funzionalità muscolare, con importanti perdite di forza e potenza (1). A livello fisiologico-molecolare, la perdita di massa muscolare e la sua progressione verso la sarcopenia coinvolgono diversi meccanismi tra loro correlati: 1) incremento delle vie di segnalazione che regolano processi catabolici (degradativi); 2) riduzione della sintesi proteica; 3) variazioni negative dell’assetto endocrino; 4) aumento della produzione di citochine pro-infiammatorie; 5) comparsa di eventi degenerativi neuronali (2). La sarcopenia ha importanti implicazioni per la salute, poiché compromette la mobilità e l’autonomia degli individui, aumentando il rischio di disabilità e riducendo la qualità della vita (3). Parallelamente alla perdita di massa muscolare, si verifica un incremento della massa grassa, con una tendenza alla ridistribuzione del tessuto adiposo. In particolare, si assiste ad un aumento dell’accumulo di grasso viscerale, il quale è stato associato a un maggiore rischio di sviluppare patologie metaboliche come il diabete di tipo II e cardiovascolari come l’aterosclerosi (4). Anche il tessuto osseo subisce alterazioni significative con l’avanzare dell’età. La perdita di densità minerale ossea è, infatti, un fenomeno comune, soprattutto nelle donne dopo la menopausa, che può portare allo sviluppo di osteoporosi nelle decadi più avanzate, con profonde ripercussioni sulla mobilità e sulla resistenza meccanica dell’osso, aumentando il rischio di fratture (5). Questi cambiamenti nella composizione corporea non solo compromettono la qualità della vita dell’individuo, ma rappresentano anche un crescente onere per i sistemi sanitari, a causa dell’aumento dei costi legati alla gestione delle condizioni associate all’invecchiamento, come fratture, perdita di autonomia e ospedalizzazioni (6).
Figura 2. Sistema Cr/PCr/CK. ADP, adenosina difosfato; ATP, adenosina trifosfato; CK, creatin chinasi; Cr, creatina; PCr, fosfocreatina; CRT, Creatina trasportatore.Modificato da (3).
COMPOSIZIONE CORPOREA E INVECCHIAMENTO
Le recenti ricerche sulla composizione corporea e il concetto di "healthy aging" ovvero invecchiare in salute, hanno evidenziato strategie sempre più mirate per favorire la cosiddetta “ricomposizione corporea”, intesa come riduzione della massa grassa associata al mantenimento o all'incremento della massa magra (muscolo e osso). Il recentissimo editoriale "New insights and advances in body recomposition" pubblicato su Frontiers in Nutrition sottolinea come questo sia possibile attraverso adeguate strategie di nutrizione ed esercizio fisico in differenti gruppi di popolazione (7). Evidenze aggiornate hanno consolidato il ruolo positivo delle diete con un buon contenuto proteico abbinate a moderate restrizioni caloriche, insieme all’allenamento contro resistenza (di forza), fondamentale per preservare la massa muscolare (8). Un recente trial clinico ha dimostrato, infatti, che un apporto proteico giornaliero pari a 1,6 g/kg/die, rispetto all’attuale raccomandato (0,8 g/kg/die), favorisce miglioramenti più significativi della massa muscolare scheletrica e della forza muscolare, in soggetti sani e non allenati di età superiore a 60 anni, senza alterare la funzionalità epatica e renale (9). Le diete che apportano un maggior contenuto di proteine rispetto ai valori di assunzione giornaliera raccomandata (RDA) da tempo sono al centro di molte discussioni. Tra queste, uno degli argomenti “critici” riguarda la salute dell’osso. Secondo “l'ipotesi del carico acido”, infatti, un'elevata assunzione di alimenti proteici (specialmente carne, pesce e latticini), sarebbe dannosa per la salute ossea, a causa dei loro componenti dietetici "acidogeni", come ad esempio gli ioni fosfato (PO₄³⁻) (10). La liberazione di questi ioni andrebbe a disturbare l'equilibrio acido-base dell'organismo, provocando un aumento della demineralizzazione ossea, con perdita di calcio nelle urine e rilascio di bicarbonato allo scopo di neutralizzare l'acidosi metabolica (11). Tuttavia, le evidenze meta-analitiche disponibili non supportano né l’ipotesi che una dieta ad alto apporto di fosfati danneggi la salute ossea, predisponendo all'osteoporosi, né che le diete alcaline (ricche di verdure, frutta, bevande ad alto contenuto di sali basici come citrati e a basso contenuto di fosforo) prevengano la perdita di calcio dalle ossa. Al contrario, invece, un insufficiente apporto proteico (tenendo conto degli opportuni correttivi legati a eventuale sovrappeso), dato dall’assenza di proteine animali e non adeguatamente compensato con proteine vegetali di buona qualità, può certamente compromettere nel tempo il trofismo muscolo-scheletrico (7, 10, 11).
POSIZIONI DELLA RICERCA
STEFANO ACQUADRO3 , VENERE QUINTIERO1,3 , OSCAR CRISAFULLI1 , EMANUELA LAVASELLI1 , GIUSEPPE D’ANTONA1,2 , MASSIMO NEGRO1,3
1. CRIAMS - Centro di Medicina dello Sport - Voghera, Università di Pavia
2. Dipartimento di Sanità Pubblica, Medicina Sperimentale e Forense, Università di Pavia
3. Massimo Negro – Linking Science to Ideas; Nutraceuticals, Functional Foods and Sports nutrition Research Consulting






Bio...
Stefano Acquadro, PhD
Laurea magistrale in Biotecnologie Alimentari, Vegetali ed Agroambientali. Dottorato di ricerca in Scienze Farmaceutiche e Biomolecolari. Master in Dietetica e Nutrizione Clinica e certificato SANIS. Abilitato alla professione di Biologo nutrizionista. Collabora con il team “Massimo Negro – Linking Science to Ideas” nell’area R&D in campo nutraceutico.
Venere Quintiero, MSc
Laurea in Scienze Biologiche e Laurea Magistrale in Alimentazione e Nutrizione Umana. Abilitata alla professione di Biologo Nutrizionista è attualmente iscritta al Master di II livello in Nutrizione Umana, presso l’Università degli Studi di Pavia. Collabora con il CRIAMS-Centro di Medicina dello Sport Voghera dell’Università di Pavia e con il team guidato dal Dr. Negro per la ricerca nel campo delle supplementazioni dietetiche e nutraceutiche, a livello clinico e sportivo.
Oscar Crisafulli, PhD
Dottore magistrale in Scienze e Tecniche delle Attività Motorie Preventive e Adattate e Dottore di Ricerca in Neuroscienze. Attualmente in forza all’Università degli Studi di Pavia in qualità di docente a contratto di Anatomia Umana per il corso di laurea in Scienze Motorie. È assegnista di ricerca presso il CRIAMS-Centro di Medicina dello Sport di Voghera, dove si occupa di esercizio fisico, nutrizione e composizione corporea in pazienti miopatici. Autore di lavori scientifici pubblicati su riviste internazionali indicizzate, fa parte del comitato editoriale, in qualità di revisore, delle riviste Frontiers in Physiology, Frontiers in Sports and Active Living e Frontiers in Human Neuroscience.
Emanuela Lavaselli, RD
Laurea in dietistica clinica con abilitazione alla professione presso l'Università degli studi di Pavia e master in dietetica clinica applicata alla nutrizione artificiale presso l'Università degli studi ti Torino. Collabora con il CRIAMS-Centro di Medicina dello Sport Voghera dell’Università degli studi di Pavia e con il team guidato dal prof. D'antona nelle attività cliniche e di ricerca nel campo della fisiologia dell’esercizio e delle supplementazioni nutrizionali in pazienti in salute e in patologia.
Giuseppe D’Antona, MD, PhD
Medico Chirurgo, specialista in Medicina dello Sport e Dottore di Ricerca in Fisiologia è Professore Associato di Scienza dell’Esercizio fisico presso l'Università degli Studi di Pavia nonché Direttore del CRIAMS-Centro di Medicina dello Sport Voghera dove supervisiona attività clinica e di ricerca nel campo della fisiologia dell’esercizio e delle supplementazioni nutrizionali. È autore di numerosi lavori scientifici su riviste internazionali peer reviewed, tra cui Nature e Science. Attualmente è Editor in Chief di Frontiers in Exercise Physiology e partecipa al comitato editoriale di diverse riviste internazionali.
Massimo Negro, PhD
Dottore di Ricerca in Scienze Biomediche, è fondatore e titolare di “Massimo Negro – Linking Science to Ideas”: brand dedicato alla consulenza scientifica e alla formazione specialistica. Collabora con il CRIAMS-Centro di Medicina dello Sport Voghera dell’Università di Pavia per la ricerca nel campo delle supplementazioni dietetiche e nutraceutiche, a livello clinico e sportivo. Autore di lavori scientifici pubblicati su riviste internazionali peer reviewed, da oltre 20 anni è docente di Nutrizione dello Sport in corsi universitari e scuole di formazione post-laurea. Insieme al prof. D’antona ha pubblicato diverse ricerche sull’uso dei supplementi nutraceutici, indagandone gli effetti sull’invecchiamento.






Per contrastare i cambiamenti della composizione corporea legati all’invecchiamento, è fondamentale un approccio integrato che includa attività fisica, alimentazione e integrazione nutraceutica. Se l’allenamento contro resistenza (pesi, macchine, ecc) preserva la massa muscolare e la funzionalità metabolica, e una dieta bilanciata fornisce i nutrienti necessari per supportare questi processi, l’integrazione nutraceutica apporta specifici nutrienti e fattori complementari che offrono uno strumento efficace per riequilibrare alterazioni biochimico-molecolari in particolare a carico di muscolo e osso.
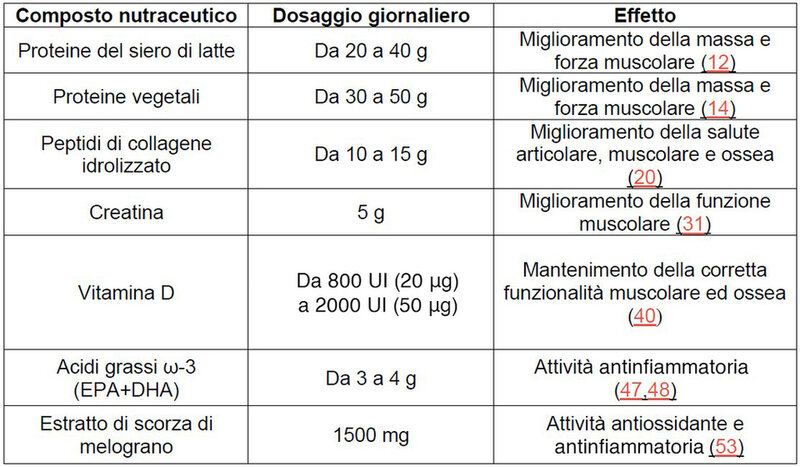
Integrazione proteica (whey protein, proteine vegetali, collagene)
Le proteine del siero di latte (whey protein) rappresentano una fonte proteica a rapida digestione e assorbimento, che le rende ideali per il recupero post-esercizio, per ottimizzare l'anabolismo muscolare e per prevenire la sarcopenia (12). Grazie alla loro elevata biodisponibilità e al ricco contenuto di aminoacidi essenziali (EAA), in particolare di leucina, le whey protein attivano le vie molecolari regolate dal complesso mTOR, stimolando in maniera indiretta la traslocazione di mTORC1 dal lisosoma al citoplasma e inducendo la sua successiva attivazione: passaggi chiave per lo stimolo della sintesi proteica muscolare (13).
Le proteine vegetali hanno un profilo aminoacidico meno ricco di EAA, danno incrementi aminoacidemici meno “rapidi” rispetto alle whey protein, e la loro capacità anabolica dipende molto dalle combinazioni delle proteine presenti nel blend (14, 15). In particolare, le proteine di soia e pisello sono tra le più utilizzate in ambito dietetico-nutraceutico per il loro valore biologico relativamente elevato e per la loro buona digeribilità (15). Tuttavia, le fonti proteiche vegetali sono spesso ricche di composti bioattivi, tra cui polifenoli e fibre, che possono offrire ulteriori benefici per la salute metabolica (16), cardiovascolare (17) e gastrointestinale (18). Le fonti proteiche derivate dal collagene, come la gelatina e l'idrolizzato di collagene, sono naturalmente ricche di glicina e prolina e per questo più indicate rispetto alle proteine del latte per stimolare la produzione di collagene del sistema osteo-tendineo-legamentoso (19, 20). I peptidi di collagene idrolizzato, pur avendo un basso contenuto di EAA, migliorano la forza muscolo-tendinea (21). I peptidi derivati dalla digestione del collagene idrolizzato, in particolare il peptide idrossiprolil-glicina, hanno, infatti, dimostrato di avere un effetto anabolico sul tessuto connettivo e muscolare, regolando la via di segnalazione di mTOR (22). Tali proteine, inoltre, promuovono il mantenimento e la mineralizzazione del tessuto osseo (23, 24, 25, 26).
Creatina
La creatina è una sostanza presente in organi come cuore e cervello ma viene prevalentemente immagazzinata nel muscolo scheletrico (circa il 95%) sotto forma di fosfocreatina: riserva energetica per la rigenerazione dell'adenosina trifosfato (ATP) durante l’attività fisica breve e intensa (27). Diversi studi hanno dimostrato come l'integrazione di creatina monoidrato, in aggiunta a un protocollo di allenamento di forza, possa incrementare le riserve di fosfocreatina nelle fibre muscolari di tipo II, aumentando la massa e la forza del muscolo in soggetti adulti e anziani (28, 29, 30, 31). I suoi benefici derivano dall’ottimizzazione bioenergetica del muscolo (32), dalla riduzione della degradazione proteica (30), dalla stimolazione delle cellule satelliti (33, 34) e dall’aumento nell’espressione di fattori miogeninici di regolazione associati a proteine muscolari come la miosina, l’α-actinina, la troponina I e la creatin chinasi (35).
Vitamina D
A livello muscolare la vitamina D partecipa ai processi di miogenesi fibrale, alla regolazione della sintesi proteica e al metabolismo mitocondriale (36), mentre a livello osseo la vitamina D favorisce l'assorbimento di ioni calcio e la mineralizzazione della matrice (37). La carenza di vitamina D è associata a perdita di massa ossea, problemi di mineralizzazione a lungo termine, con un maggior rischio di osteoporosi e fratture (38), ad atrofia delle fibre muscolari, aumento del rischio di dolore muscolo-scheletrico cronico e sarcopenia (39, 40). Nel muscolo, in particolare, la vitamina D agisce sia attraverso una via genomica, che modula la trascrizione genica nei mioblasti e aumenta la sintesi di miosina e proteine leganti il calcio, sia attraverso una via non genomica, che regola i canali del calcio e favorisce l’accoppiamento eccitazione-contrazione (39, 41). Studi retrospettivi e numerose position stand hanno messo in relazione i bassi livelli sierici di vitamina D (<50 nmol/L) riscontrabili nelle popolazioni anziane (42), con la riduzione delle prestazioni fisiche (43), della mobilità (44), della forza muscolare (44) e a maggiore disabilità (43).
Acidi grassi omega-3 (ω-3)
Gli acidi grassi ω-3, in particolare l'acido eicosapentaenoico (EPA) e l'acido docosaesaenoico (DHA), esercitano un ruolo chiave nel mantenimento della massa muscolare e nella prevenzione della sarcopenia (45), attraverso meccanismi come la stimolazione della via mTOR, l’aumento della sensibilità insulinica (46), e la modulazione della risposta infiammatoria, riducendo la produzione di citochine pro-infiammatorie (46). Studi recenti dimostrano che un’integrazione di ω-3 per almeno otto settimane può migliorare la forza muscolare e aumentare la massa magra, sia in soggetti sani (47), sia in popolazioni anziane (48), con effetti superiori quando associata all’esercizio fisico contro resistenza (46).
Estratti vegetali di melograno
La ricerca scientifica ha dimostrato che il succo di melograno, riconosciuto come alimento funzionale, è ricco di fitonutrienti come polifenoli, tannini, antocianine e flavonoidi, noti per il loro elevato potere antiossidante e antinfiammatorio (49). Inoltre, anche le parti non edibili del frutto e della pianta, come la scorza, le foglie e la corteccia, possono essere utilizzate per ottenere estratti biologicamente attivi, ricchi di punicalagine ed ellagitannini, e di molecole terpeniche, tra cui gli acidi triterpenici ursolico, oleanolico e betulinico (50). I composti polifenolici presenti negli estratti contribuiscono alla protezione del muscolo scheletrico dallo stress ossidativo e dall'infiammazione cronica attraverso diversi meccanismi molecolari. L'azione antiossidante si manifesta con la riduzione dei marker di stress ossidativo, come la malondialdeide, accompagnata da un incremento dell’attività degli enzimi antiossidanti, tra cui la superossido dismutasi, la glutatione perossidasi e la catalasi (51, 52). Parallelamente, l’infiammazione viene modulata attraverso l’inibizione del fattore di trascrizione NF-κB e delle chinasi MAPKs, JNK ed ERK, con una conseguente riduzione del rilascio di interleuchine IL-1β e IL-6, e della fosforilazione del fattore di trascrizione STAT3, coinvolto nella regolazione della risposta infiammatoria (51, 52, 53). Anche gli acidi triterpenici contribuiscono all’azione antinfiammatoria, inibendo, inoltre, enzimi chiave come la ciclo-ossigenasi-2 e la sintesi di prostaglandine pro-infiammatorie (come la PGE2), amplificando così l’effetto antinfiammatorio complessivo (54).
STRATEGIE DI PREVENZIONE E TRATTAMENTO: DALL’ATTIVITÀ FISICA ALL’INTEGRAZIONE NUTRACEUTICA
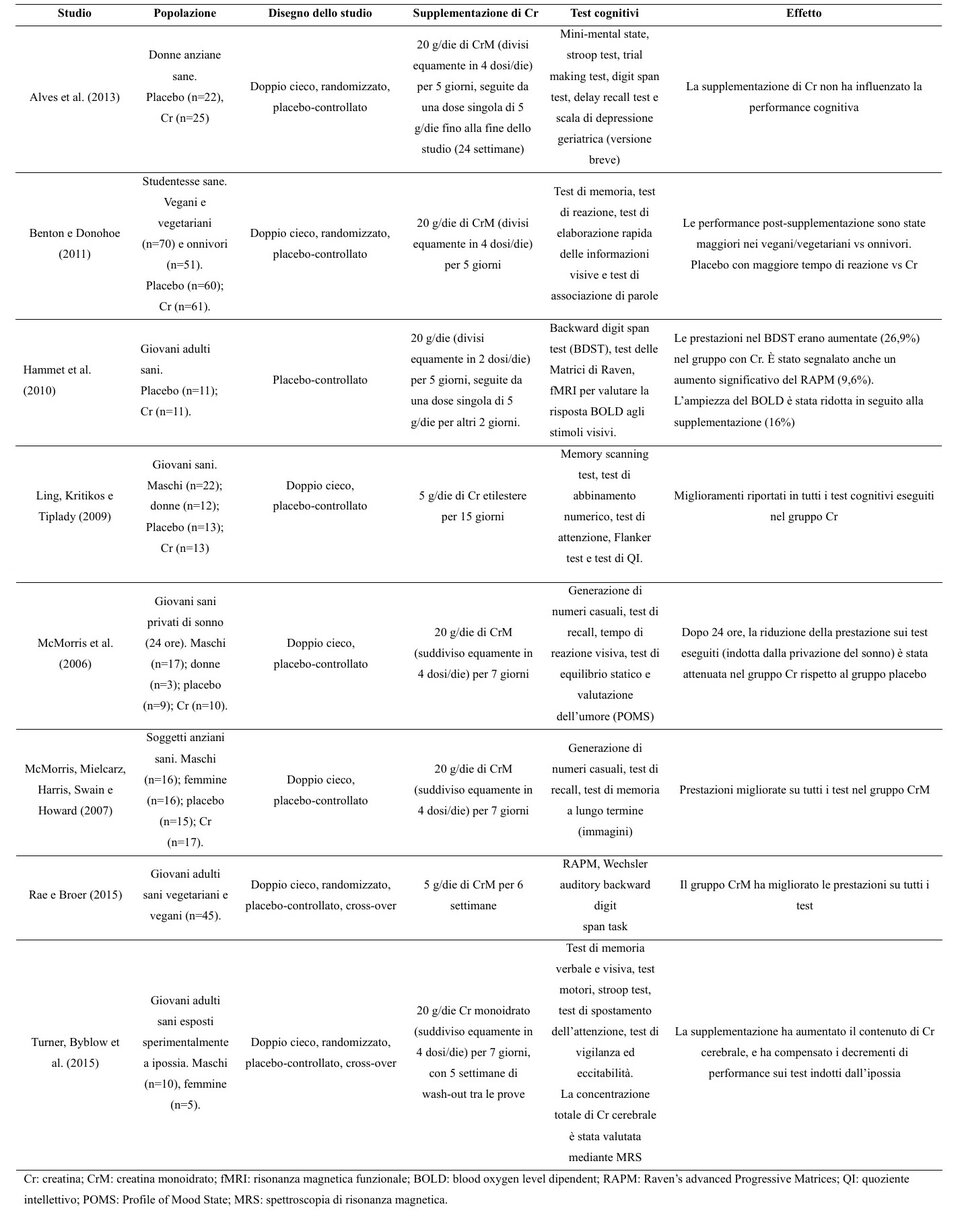
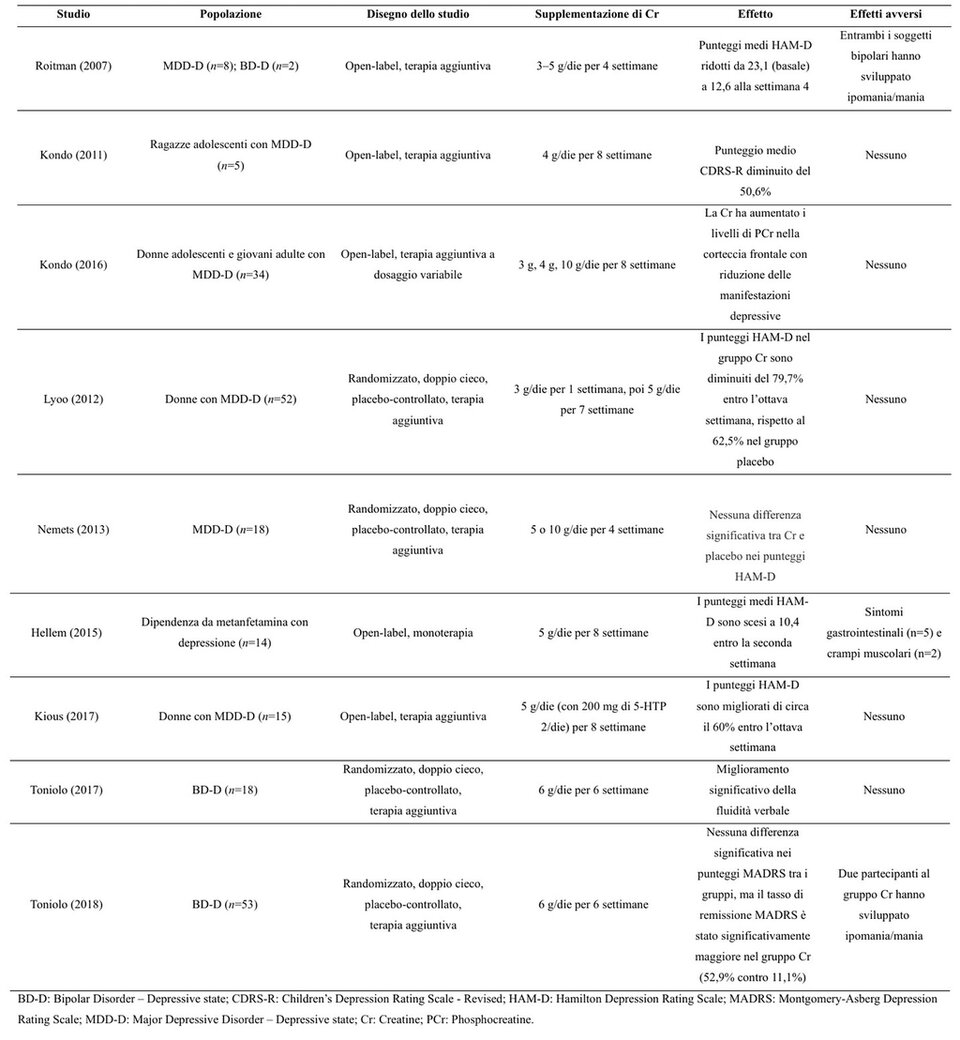
Tabella 1. Alcuni studi sugli effetti della supplementazione di Cr sulle prestazioni cognitive in soggetti sani (13). Clicca sull'immagine per ingrandire.
Nonostante l’invecchiamento muscolare sia un tema centrale nella ricerca scientifica, i programmi di salute pubblica sono ancora orientati a monitorare indicatori che non tengono adeguatamente conto dell’impatto che la perdita progressiva di massa muscolare e di forza (età-dipendente) possono avere sulla qualità della vita e sull’assetto metabolico dell’intero organismo. La comunità scientifica da anni ha identificato l’invecchiamento muscolare, e soprattutto la sarcopenia, come uno dei principali fattori di rischio d’insorgenza di patologie croniche-degenerative nelle decadi di vita più avanzate. Investire risorse di ricerca nella salute muscolare rappresenta una grande opportunità per le aziende del settore nutraceutico. I target innovativi dovrebbero considerare lo sviluppo di prodotti maggiormente differenziati (per tipologia di principi attivi e blend, dosaggi, indicazioni d’uso) che tengano conto delle caratteristiche degli utilizzatori a cui sono destinati: fascia di età (adulti, soggetti middle-aged, senior, grandi anziani), specificità biologica sesso-specifica (che impatta sulla diversa progressione dell’invecchiamento), stile di vita (moderatamente attivi, molto attivi o sportivi), eventuale presenza di patologie (ad esempio diabete e sindrome metabolica, malattie cardiovascolari, miopatie) che influenzano negativamente la progressione dell’aging muscolare.
PROSPETTIVE FUTURE
Riferimenti bibliografici
- Rosenberg I. Sarcopenia : Diagnosis and Mechanisms Sarcopenia : Origins and Clinical Relevance. Clin Geriatr Med. 2011;27(3):337–9. https://pubmed.ncbi.nlm.nih.gov/21824550/
- Xia Z, Cholewa J, Zhao Y, Shang HY, Yang YQ, Pessôa KA, et al. Targeting inflammation and downstream protein metabolism in sarcopenia: A brief up-dated description of concurrent exercise and leucine-based multimodal intervention. Front Physiol. 2017;8(JUN):1–7. https://pmc.ncbi.nlm.nih.gov/articles/PMC5479895/
- Cruz-Jentoft AJ, Bahat G, Bauer J, Boirie Y, Bruyère O, Cederholm T, et al. Sarcopenia: Revised European consensus on definition and diagnosis. Age Ageing. 2019;48(1):16–31. https://pubmed.ncbi.nlm.nih.gov/30312372/
- Barazzoni R, Bischoff S, Boirie Y, Busetto L, Cederholm T, Dicker D, et al. Sarcopenic Obesity: Time to Meet the Challenge. Obes Facts. 2018;11(4):294–305. https://pubmed.ncbi.nlm.nih.gov/30016792/
- Compston JE, McClung MR, Leslie WD. Osteoporosis. Lancet. 2019;393(10169):364–76. https://pubmed.ncbi.nlm.nih.gov/30696576/
- Clegg A, Young J, Iliffe S, Rikkert M, Rockwood K. Frailty in Older People. Lancet. 2013;381(9868):752–62. https://pubmed.ncbi.nlm.nih.gov/23395245/
- Bonilla DA, Petro JL, Cannataro R, Kreider RB, Stout JR. Editorial: New insights and advances in body recomposition. Front Nutr. 2024;11(3). https://www.frontiersin.org/journals/nutrition/articles/10.3389/fnut.2024.1467406/full
- Campbell BI, Aguilar D, Colenso-Semple LM, Hartke K, Fleming AR, Fox CD, et al. Intermittent energy restriction attenuates the loss of fat free mass in resistance trained individuals. A randomized controlled trial. J Funct Morphol Kinesiol. 2020;5(1):1–12. https://pubmed.ncbi.nlm.nih.gov/33467235/
- Bagheri R, Shakibaee A, Camera DM, Sobhani V, Ghobadi H, Nazar E, et al. Effects of 8 weeks of resistance training in combination with a high protein diet on body composition, muscular performance, and markers of liver and kidney function in untrained older ex-military men. Front Nutr. 2023;10(June):1–14. https://pubmed.ncbi.nlm.nih.gov/37457969/
- Fenton TR, Lyon AW, Eliasziw M, Tough SC, Hanley DA. Phosphate decreases urine calcium and increases calcium balance: a meta-analysis of the osteoporosis acid-ash diet hypothesis. Nutr J. 2009;8:41. https://pmc.ncbi.nlm.nih.gov/articles/PMC2761938/
- Fenton TR, Tough SC, Lyon AW, Eliasziw M, Hanley DA. Causal assessment of dietary acid load and bone disease: A systematic review & meta-analysis applying Hill’s epidemiologic criteria for causality. Nutr J. 2011;10(1):41. https://pubmed.ncbi.nlm.nih.gov/21529374/
- Kamińska MS, Rachubińska K, Grochans S, Skonieczna-Żydecka K, Cybulska AM, Grochans E, et al. The Impact of Whey Protein Supplementation on Sarcopenia Progression among the Elderly: A Systematic Review and Meta-Analysis. Nutrients. 2023;15(9):1–22. https://pubmed.ncbi.nlm.nih.gov/37432157/
- Rehman SU, Ali R, Zhang H, Zafar MH, Wang M. Research progress in the role and mechanism of Leucine in regulating animal growth and development. Front Physiol. 2023;14(November):1–22. https://pubmed.ncbi.nlm.nih.gov/38046946/
- Kerksick CM, Jagim A, Hagele A, Jäger R. Plant proteins and exercise: What role can plant proteins have in promoting adaptations to exercise? Nutrients. 2021;13(6):1–22. https://pubmed.ncbi.nlm.nih.gov/34200501/
- Petrusán JI, Rawel H, Huschek G. Protein-rich vegetal sources and trends in human nutrition: A review. Curr Top Pept Protein Res. 2016;17(March):1–19. https://www.researchgate.net/publication/314465563_Protein-rich_vegetal_sources_and_trends_in_human_nutrition_A_review
- Bulsiewicz WJ. The Importance of Dietary Fiber for Metabolic Health. Am J Lifestyle Med. 2023;17(5):639–48. https://pubmed.ncbi.nlm.nih.gov/37711348/
- Iqbal I, Wilairatana P, Saqib F, Nasir B, Wahid M, Latif MF, et al. Plant Polyphenols and Their Potential Benefits on Cardiovascular Health: A Review. Molecules. 2023;28(17):1–31. https://pmc.ncbi.nlm.nih.gov/articles/PMC10490098/
- González-Aguilar GA, Blancas-Benítez FJ, Sáyago-Ayerdi SG. Polyphenols associated with dietary fibers in plant foods: molecular interactions and bioaccessibility. Curr Opin Food Sci. 2017;13:84–8. https://www.sciencedirect.com/science/article/pii/S2214799317300516
- Vieira CP edroz., De Oliveira LP, Da Ré Guerra F, Dos Santos De Almeida M, Marcondes MC ristin. CG ome., Pimentel ER os. Glycine improves biochemical and biomechanical properties following inflammation of the achilles tendon. Anat Rec (Hoboken). 2015;298(3):538–45. https://pubmed.ncbi.nlm.nih.gov/25156668/
- Susan M Tyree , Gillian Dunn Galvin CBB and TGD. A Randomized, Double-Blind, Placebo- Controlled Study Trial to Evaluate the Potential Effects of Naticol®, Fish Collagen Peptides on Symptoms of Sarcopenia in the Elderly. Juniper Online J Case Stud. 2021;12(5):1–8. https://juniperpublishers.com/jojcs/JOJCS.MS.ID.555850.php
- Zdzieblik D, Jendricke P, Oesser S, Gollhofer A, König D. The influence of specific bioactive collagen peptides on body composition and muscle strength in middle-aged, untrained men: A randomized controlled trial. Int J Environ Res Public Health. 2021;18(9). https://pubmed.ncbi.nlm.nih.gov/33946565/
- Kitakaze T, Sakamoto T, Kitano T, Inoue N, Sugihara F, Harada N, et al. The collagen derived dipeptide hydroxyprolyl-glycine promotes C2C12 myoblast differentiation and myotube hypertrophy. Biochem Biophys Res Commun. 2016;478(3):1292–7. https://pubmed.ncbi.nlm.nih.gov/27553280/
- Khatri M, Naughton RJ, Clifford T, Harper LD, Corr L. The effects of collagen peptide supplementation on body composition, collagen synthesis, and recovery from joint injury and exercise: a systematic review. Amino Acids. 2021;53(10):1493–506. https://pmc.ncbi.nlm.nih.gov/articles/PMC8521576/
- König D, Oesser S, Scharla S, Zdzieblik D, Gollhofer A. Specific collagen peptides improve bone mineral density and bone markers in postmenopausal women—A randomized controlled study. Nutrients. 2018;10(1). https://pubmed.ncbi.nlm.nih.gov/29337906/
- Zdzieblik D, Oesser S, König D. Specific bioactive collagen peptides in osteopenia and osteoporosis: Long-term observation in postmenopausal women. J Bone Metab. 2021;28(3):207–13. https://pubmed.ncbi.nlm.nih.gov/34520654/
- Cúneo F, Costa-Paiva L, Pinto-Neto AM, Morais SS, Amaya-Farfan J. Effect of dietary supplementation with collagen hydrolysates on bone metabolism of postmenopausal women with low mineral density. Maturitas. 2010;65(3):253–7. https://pubmed.ncbi.nlm.nih.gov/19892499/
- Negro M, Avanzato I, D’Antona G. Creatine in skeletal muscle physiology. Nonvitamin and Nonmineral Nutritional Supplements. Elsevier Inc.; 2018. 59–68 p. https://www.sciencedirect.com/science/article/abs/pii/B9780128124918000084?via%3Dihub
- Candow DG, Forbes SC, Kirk B, Duque G. Current evidence and possible future applications of creatine supplementation for older adults. Nutrients. 2021;13(3):1–18. https://pubmed.ncbi.nlm.nih.gov/33652673/
- Forbes SC, Candow DG, Ostojic SM, Roberts MD, Chilibeck PD. Meta-analysis examining the importance of creatine ingestion strategies on lean tissue mass and strength in older adults. Nutrients. 2021;13(6):1–14. https://pubmed.ncbi.nlm.nih.gov/34199420/
- Kreider RB, Kalman DS, Antonio J, Ziegenfuss TN, Wildman R, Collins R, et al. International Society of Sports Nutrition position stand: Safety and efficacy of creatine supplementation in exercise, sport, and medicine. J Int Soc Sports Nutr. 2017;14(1):1–18. https://jissn.biomedcentral.com/articles/10.1186/s12970-017-0173-z
- Phillips SM. Nutritional supplements in support of resistance exercise to counter age-related sarcopenia. Adv Nutr. 2015;6(4):452–60. https://pubmed.ncbi.nlm.nih.gov/26178029/
- Bonilla DA, Kreider RB, Stout JR, Forero DA, Kerksick CM, Roberts MD, et al. Metabolic basis of creatine in health and disease: A bioinformatics-assisted review. Vol. 13, Nutrients. 2021. 1–32 p. https://pubmed.ncbi.nlm.nih.gov/33918657/
- Kim J, Lee J, Kim S, Yoon D, Kim J, Sung DJ. Role of creatine supplementation in exercise-induced muscle damage: A mini review. J Exerc Rehabil. 2015;11(5):244–50. https://pmc.ncbi.nlm.nih.gov/articles/PMC4625651/
- Olsen S, Aagaard P, Kadi F, Tufekovic G, Verney J, Olesen JL, et al. Creatine supplementation augments the increase in satellite cell and myonuclei number in human skeletal muscle induced by strength training. J Physiol. 2006;573(2):525–34. https://pubmed.ncbi.nlm.nih.gov/16581862/
- Willoughby DS, Rosene JM. Effects of oral creatine and resistance training on myogenic regulatory factor expression. Med Sci Sports Exerc. 2003;35(6):923–9. https://pubmed.ncbi.nlm.nih.gov/12783039/
- Latham CM, Brightwell CR, Keeble AR, Munson BD, Thomas NT, Zagzoog AM, et al. Vitamin D Promotes Skeletal Muscle Regeneration and Mitochondrial Health. Front Physiol. 2021;12(April). https://pubmed.ncbi.nlm.nih.gov/33935807/
- van Driel M, van Leeuwen JPTM. Vitamin D endocrine system and osteoblasts. Bonekey Rep. 2014;3(December 2013):1–8. https://pmc.ncbi.nlm.nih.gov/articles/PMC3944124/
- Lips P, Binkley N, Pfeifer M, Recker R, Samanta S, Cohn DA, et al. Once-weekly dose of 8400 IU vitamin D3 compared with placebo: Effects on neuromuscular function and tolerability in older adults with vitamin D insufficiency. Am J Clin Nutr. 2010;91(4):985–91. https://pubmed.ncbi.nlm.nih.gov/20130093/
- Montenegro KR, Cruzat V, Carlessi R, Newsholme P. Mechanisms of Vitamin D action in skeletal muscle. Nutr Res Rev. 2019;32(2):192–204. https://pubmed.ncbi.nlm.nih.gov/31203824/
- Pludowski P, Grant WB, Karras SN, Zittermann A, Pilz S. Vitamin D Supplementation: A Review of the Evidence Arguing for a Daily Dose of 2000 International Units (50 µg) of Vitamin D for Adults in the General Population. Nutrients. 2024;16(3). https://pubmed.ncbi.nlm.nih.gov/38337676/
- Braga M, Simmons Z, Norris KC, Ferrini MG, Artaza JN. Vitamin D induces myogenic differentiation in skeletal muscle derived stem cells. Endocr Connect. 2017;6(3):139–50. https://pmc.ncbi.nlm.nih.gov/articles/PMC5424772/
- Haitchi S, Moliterno P, Widhalm K. Prevalence of vitamin D deficiency in seniors – A retrospective study. Clin Nutr ESPEN. 2023;57:691–6. https://pubmed.ncbi.nlm.nih.gov/37739724/
- Giustina A, Bouillon R, Dawson-Hughes B, Ebeling PR, Lazaretti-Castro M, Lips P, et al. Vitamin D in the older population: a consensus statement. Endocrine. 2023;79(1):31–44. https://pubmed.ncbi.nlm.nih.gov/36287374/
- Kupisz-Urbańska M, Płudowski P, Marcinowska-Suchowierska E. Vitamin d deficiency in older patients—problems of sarcopenia, drug interactions, management in deficiency. Nutrients. 2021;13(4):1–12. https://pmc.ncbi.nlm.nih.gov/articles/PMC8069639/
- Cruz-Jentoft AJ, Dawson Hughes B, Scott D, Sanders KM, Rizzoli R. Nutritional strategies for maintaining muscle mass and strength from middle age to later life: A narrative review. Maturitas. 2020;132:57–64. https://pubmed.ncbi.nlm.nih.gov/31883664/
- Jäger R, Heileson JL, Abou Sawan S, Dickerson BL, Leonard M, Kreider RB, et al. International Society of Sports Nutrition Position Stand: Long-Chain Omega-3 Polyunsaturated Fatty Acids. J Int Soc Sports Nutr. 2025;22(1):2441775. https://pubmed.ncbi.nlm.nih.gov/39810703/
- Smith GI, Atherton P, Reeds DN, Mohammed BS, Rankin D, Rennie MJ, et al. Omega-3 polyunsaturated fatty acids augment the muscle protein anabolic response to hyperinsulinaemia-hyperaminoacidaemia in healthy young and middle-aged men and women. Clin Sci. 2011;121(6):267–78. https://pubmed.ncbi.nlm.nih.gov/21501117/
- Smith GI, Atherton P, Reeds DN, Mohammed BS, Rankin D, Rennie MJ, et al. Dietary omega-3 fatty acid supplementation increases the rate of muscle proteinsynthesis in older adults.pdf. 2011;402–12. https://pubmed.ncbi.nlm.nih.gov/21159787/
- Fahmy H, Hegazi N, El-Shamy S, Farag MA. Pomegranate juice as a functional food: A comprehensive review of its polyphenols, therapeutic merits, and recent patents. Food Funct. 2020;11(7):5768–81. https://pubmed.ncbi.nlm.nih.gov/32608443/
- Sanna C, Marengo A, Acquadro S, Caredda A, Lai R, Corona A, et al. In Vitro Anti-HIV-1 Reverse Transcriptase and Integrase Properties of Punica granatum L. Leaves, Bark, and Peel Extracts and Their Main Compounds. Plants. 2021; https://www.mdpi.com/2223-7747/10/10/2124
- Dormal V, Pachikian B, Debock E, Buchet M, Copine S, Deldicque L. Evaluation of a Dietary Supplementation Combining Protein and a Pomegranate Extract in Older People: A Safety Study. Nutrients. 2022;14(23):1–9. https://pubmed.ncbi.nlm.nih.gov/36501211/
- Sayed S, Alotaibi SS, El-Shehawi AM, Hassan MM, Shukry M, Alkafafy M, et al. The Anti-Inflammatory, Anti-Apoptotic and Antioxidant Effects of a Pomegranate-Peel Extract against Acrylamide-Induced Hepatotoxicity in Rats. Life. 2022;12(2). https://pmc.ncbi.nlm.nih.gov/articles/PMC8878900/
- Barghchi H, Milkarizi N, Belyani S, Norouzian Ostad A, Askari VR, Rajabzadeh F, et al. Pomegranate (Punica granatum L.) peel extract ameliorates metabolic syndrome risk factors in patients with non-alcoholic fatty liver disease: a randomized double-blind clinical trial. Nutr J. 2023;22(1):1–17. https://pmc.ncbi.nlm.nih.gov/articles/PMC10464300/
- Miranda R de S, de Jesus B da SM, da Silva Luiz SR, Viana CB, Adão Malafaia CR, Figueiredo F de S, et al. Antiinflammatory activity of natural triterpenes—An overview from 2006 to 2021. Phyther Res. 2022;36(4):1459–506. https://onlinelibrary.wiley.com/doi/10.1002/ptr.7359
PEER REVIEWED
HEALTHY AGEING
KEYWORDS
Invecchiamento
Healthy ageing
Nutrizione
Nutraceutici
L'invecchiamento comporta modifiche significative nella composizione corporea, con la perdita di massa muscolare (fino alla comparsa della sarcopenia), l’aumento della massa grassa e la riduzione della densità ossea: tutti fattori che influenzano la qualità della vita. Strategie mirate di nutrizione, esercizio fisico e integrazione nutraceutica possono contrastare questi cambiamenti, promuovendo la ricomposizione corporea, che include la riduzione della massa grassa e il miglioramento della massa muscolare. L'assunzione ciclica di prodotti a base di proteine, creatina, acidi grassi omega-3, vitamina D e collagene, combinata con allenamento contro resistenza, può essere efficace per preservare la salute muscolare e ossea. Un approccio integrato e personalizzato rappresenta una promettente via per l'invecchiamento in salute.




