I FITOTERAPICI:
QUESTI (S)CONOSCIUTI

Il mercato italiano ed europeo offre un elevato numero di prodotti salutistici che contengono sostanze vegetali come piante o parti di piante, le alghe, i funghi e i licheni, o loro estratti. In molti casi, seppur simili, questi prodotti presentano sostanziali differenze nella loro classificazione legale (1). La categorizzazione è legata alla presentazione dei prodotti, basata su un quadro giuridico adeguato, comune a tutti i paesi europei. Pertanto, i medicinali vegetali (fitoterapici), gli integratori alimentari, i cosmetici e i dispositivi medici, rappresentano i segmenti di mercato dei prodotti botanici (2). I medicinali vegetali e dispositivi medici vantano proprietà medicinali, mentre i cosmetici e gli integratori alimentari sono prodotti salutistici (3). Di conseguenza, i preparati botanici contenenti le stesse piante possono assumere indicazioni diverse con indicazioni medicinali o sulla salute e diverse posizioni legali di mercato non soltanto italiano ma europeo perché la legislazione è europea.
INTRODUZIONE
Le preparazioni solide per via orale, si distinguono dalle forme convenzionali o a pronto rilascio, le quali non presentano effetti sulla cessione del principio attivo e sulla solubilità in acqua e capacità di diffondere attraverso le barriere biologiche. Sono oggi disponibili anche forme farmaceutiche non convenzionali o a rilascio modificato, progettate per modulare opportunamente la cessione del principio attivo, al fine di ottenere una azione locale o sistemica, con modalità sito specifiche e temporali. Le forme convenzionali comprendono forme solide e forme liquide. In particolare, nelle forme farmaceutiche in soluzioni l’attivo già solubilizzato, pronto per essere assorbito dalla mucosa gastroenterica. Per le forme solide il processo di solubilizzazione è più complesso e nelle farmacopee sono riportati modelli in vitro per riprodurre i fenomeni che portano alla solubilizzazione degli attivi, valutando cosa accade a seguito di una somministrazione orale. Infatti, nel caso di compresse si possono valutare i processi di disintegrazione (sinonimo disaggregazione o disgregazione) e dissoluzione studiati attraverso i test di dissoluzione, quest’ultimo permette di studiare la velocità con la quale il farmaco raggiunge la circolazione sistemica. Per questo per tutte le forme di dosaggio per uso orale a rilascio immediato, quali polveri, granulati, capsule rigide e compresse, specialmente nel caso contengano sostanze poco solubili nei mezzi acquosi, necessitano come requisito lo step della dissoluzione che peraltro rappresenta il passaggio limitante l’assorbimento e la biodisponibilità sistemica (Figura 1). Nel momento in cui il farmaco viene a contatto con i fluidi biologici, questo si dissolve, creando una soluzione che attraversa il sistema gastrointestinale. L’assorbimento è quel processo attraverso il quale il principio attivo, attraversando la parete intestinale si trasferisce, in parte o totalmente, nel sistema circolatorio, e da questo viene distribuito in tutti gli organi o tessuti. Per queste formulazioni una buona prestazione è caratterizzata da un rilascio dei costituenti attivi del 75% entro 45 minuti. Per le forme orali solide non convenzionali, le specifiche di dissoluzione devono essere stabilite caso per caso. Ad esempio, per le forme gastroresistenti si richiedono delle specifiche con almeno due determinazioni, cioè una esposizione di una o due ore in mezzo acido ed il secondo ad un predefinito tempo di permanenza in un adatto tampone (di preferenza a pH 6,8). Se non diversamente indicato il valore finale del rilascio del principio attivo deve essere il 75%. Si possono anche eseguire test di dissoluzione comparativi. In questo caso i due profili sono considerati simili se la quantità totale degli attivi è ≥85% in 15 minuti, oppure c’è la necessità di una valutazione matematica a vari tempi nel caso il valore trovato sia <85% (1,2). Nel valutare l’efficacia di un attivo, sia esso farmaco o integratore, la biodisponibilità rappresenta un parametro essenziale. Questa è infatti definita come l’entità e la velocità con cui il principio attivo viene assorbito da un prodotto nel circolo sistemico. Anche se raramente dimostrata, sarebbe necessaria una correlazione piuttosto precisa tra il test di dissoluzione e la biodisponibilità di un principio attivo, in cui gioca un ruolo di primo piano, la sua dissoluzione nei due diversi fluidi quello gastrico o quello intestinale.
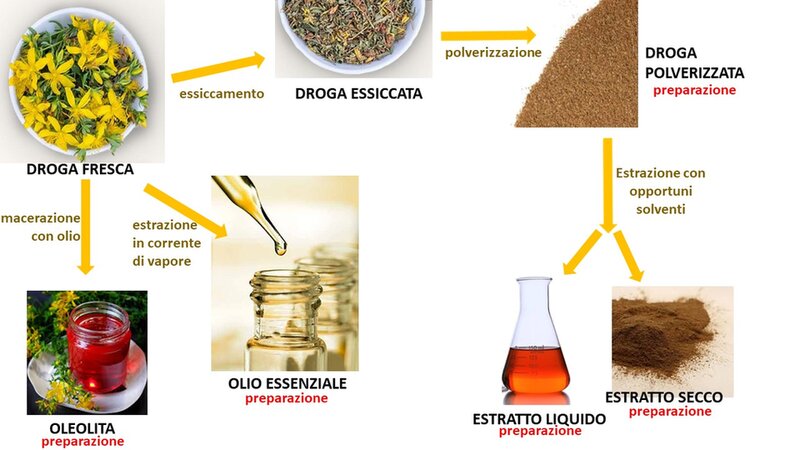
Figura 1. Processo di assorbimento delle sostanze attive da forme di dosaggio solide orali.
DEFINIZIONE E NORMATIVA DEI MEDICINALI DI ORIGINE VEGETALE
Anna Rita Bilia
Laurea in Farmacia, Dottorato di ricerca in Scienze Chimiche, Specializzazione in Scienza e della Tecnologia delle piante officinali e in Farmacia Ospedaliera, già Direttrice della Scuola di specializzazione in Farmacia Ospedaliera, Presidente del Centro Interdipartimentale di Servizi per le Biotecnologie di Interesse Agrario, Chimico, Industriale (CIBIACI). Vice-chair della ESCOP ed esperta della Farmacopea europea, già presidente della SIF e GA. Più di 260 pubblicazioni, editor di diversi giornali scientifici, titolare di brevetti.

DEFINIZIONE E NORMATIVA DEI MEDICINALI DI ORIGINE VEGETALE
Ai sensi della Direttiva 2001/83/CE (ex 65/65/CE, e modificata dalla Direttiva 2004/27/CE), relativa ai medicinali per uso umano ("Direttiva sui medicinali per uso umano"), i medicinali di origine vegetale o fitoterapici sono medicinali che contengono come sostanze attive esclusivamente una o più sostanze vegetali o una o più preparazioni vegetali, oppure una o più sostanze vegetali in associazione a una o più preparazioni vegetali (4). Si definiscono preparazioni vegetali le preparazioni ottenute sottoponendo le sostanze vegetali a trattamenti quali estrazione, distillazione, spremitura, frazionamento, purificazione, concentrazione o fermentazione (ad esempio tinture, estratti, oli essenziali, succhi ottenuti per spremitura), così come le sostanze vegetali triturate o polverizzate ed essudati lavorati (Figura 1). Le sostanze vegetali che fanno parte di questi medicinali sono definite in modo preciso in base alla parte di pianta utilizzata e alla denominazione botanica secondo la denominazione binomiale (genere, specie, varietà e autore).
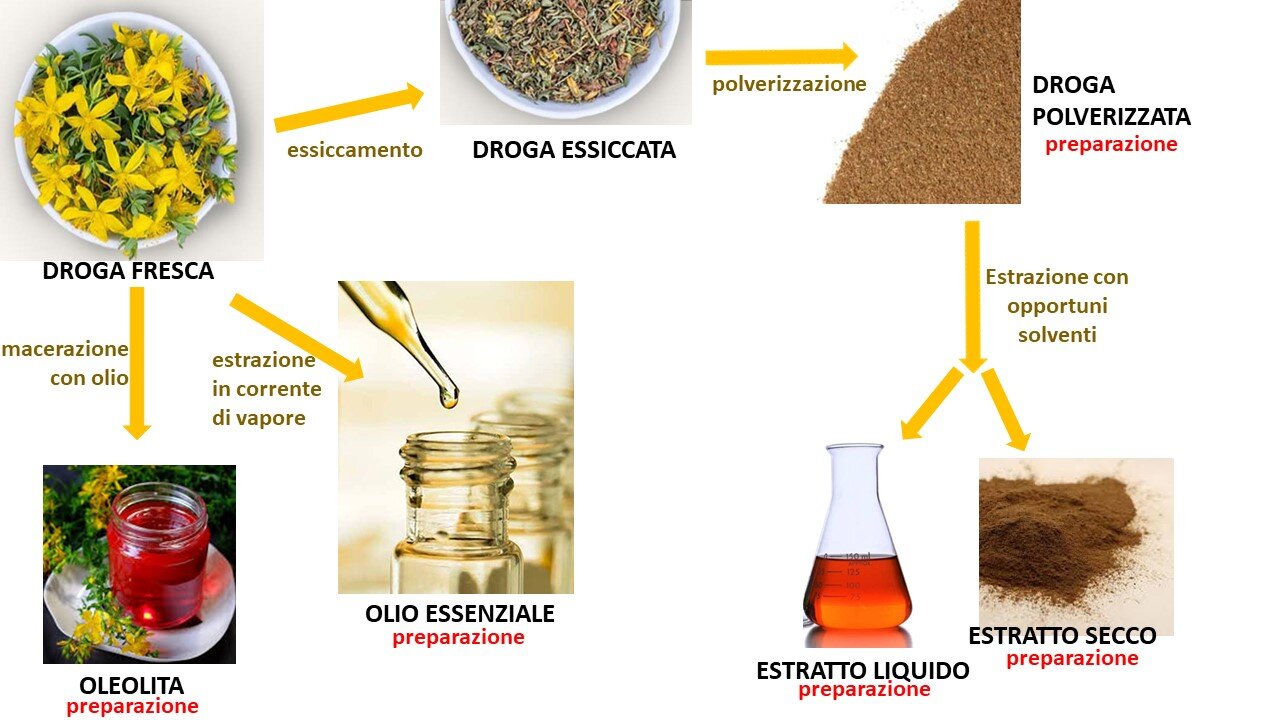
Figura 1. Preparazioni che si possono ottenere da una droga
È importante ribadire che i medicinali vegetali sono medicinali e per questo venduti solo in farmacia. Anche per i medicinali vegetali l’immissione in commercio (AIC) deve essere autorizzata dall’Agenzia Italiana del Farmaco (AIFA) o dall’Agenzia Europea per i medicinali (EMA). L’ AIC è volta a garantire la salute pubblica assicurando la qualità, la sicurezza e l’efficacia dei prodotti immessi in commercio.
Con l'obiettivo di armonizzare la regolamentazione dei medicinali vegetali, il Parlamento Europeo ha emanato la Direttiva 2004/24/CE. I medicinali vegetali (Herbal Medicinal Products, HMP) sono classificati sulla base della valutazione dei dati scientifici disponibili. I medicinali di uso consolidato, (Well Established Use, WEU), quelli tradizionali (Traditional, THMP), ed infine i medicinali vegetali che seguono le regolari procedure di registrazione per l'autorizzazione all'immissione in commercio (4), (Figura 2).
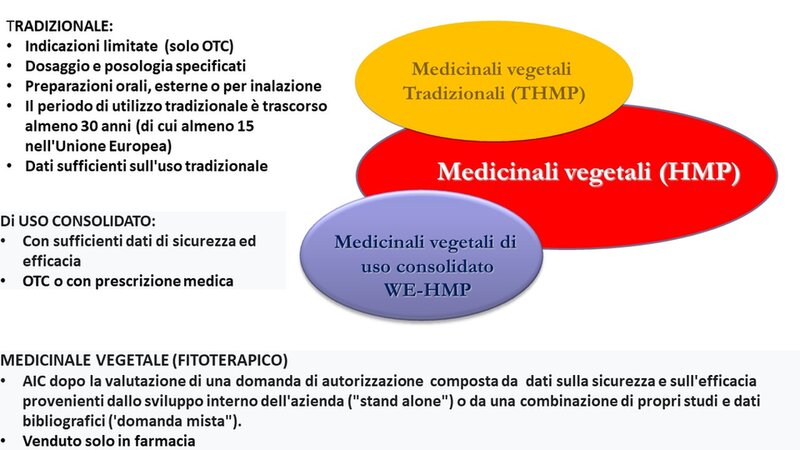
Figura 2. Classificazione dei medicinali vegetali (fitoterapici)
Ai medicinali vegetali tradizionali (THMP) si applica una registrazione semplificata sostenuta da un’efficacia plausibile poiché riferita ad un prodotto utilizzato per almeno 30 anni, di cui 15 all’interno della Comunità Europea. Per questi medicinali, non sono richiesti test clinici e studi di sicurezza e d'efficacia in quanto il loro impiego tradizionale per almeno 30 anni, implica sicurezza e plausibile efficacia. I medicinali ad uso consolidato (WE), invece, sono autorizzati secondo la procedura di uso ben consolidato solo se viene dimostrato un utilizzo ben noto del medicinale nella Comunità Europea per un tempo di almeno dieci anni. In questo caso si parla di un’efficacia dimostrata, poiché riferita a dati clinici adeguati (almeno uno studio clinico controllato o in alternativa un'esperienza clinica ben documentata con sufficienti dati farmacologici di supporto) che dimostrino efficacia in specifiche indicazioni terapeutiche e dati scientifici appropriati che dimostrino un profilo rischio/beneficio positivo.
I medicinali tradizionali vegetali sono destinati ad essere utilizzati senza la supervisione di un medico e sono rappresentati da formulazioni per uso orale, esterno o per inalazione a concentrazione e dosaggio specifici. I medicinali vegetali di uso consolidato invece possono necessitare di prescrizione medica.
Per la classificazione del tipo di medicinale vegetale vengono in aiuto le monografie dell’unione europea, ca. 170 quelle finalizzate ad oggi (5), che pur non essendo vincolanti, costituiscono la base bibliografica per l’autorizzazione dei medicinali di “uso ben consolidato” e di “uso tradizionale”. Queste monografie contengono il parere scientifico dell'HMPC sui dati di sicurezza ed efficacia di una sostanza vegetale e dei suoi preparati destinati all'uso medicinale. L'HMPC valuta tutte le informazioni disponibili, compresi i dati non clinici e clinici, ma anche l'uso e l'esperienza di lunga data documentati nell'UE. In particolare, sono riportati a cosa serve e a chi è destinato il medicinale vegetale, e le informazioni sulla sicurezza come informazioni sugli effetti indesiderati e sulle interazioni con altri medicinali. La maggior parte delle monografie ha portato all'assegnazione di un uso tradizionale della specie vegetale in esame (es. grindelia, rodiola), per altre monografie solo un uso ben consolidato (es. senna, cascara), ma per diverse specie vegetali è stato descritto sia un uso ben consolidato che tradizionale, in questo caso specificando i tipi di estratti da annoverare per un uso ben consolidato e quelli per un uso tradizionale (es. iperico, ginkgo).
Oltre alle linee guida e alle monografie elaborate dall’HMPC, per poter valutare la documentazione a supporto dell’autorizzazione all’immissione in commercio, è necessario fare riferimento alle monografie della Farmacopea Europea, sia a quelle generali che a quelle riferite a sostanze e preparazioni vegetali, e, laddove presenti anche a quelle specifiche per specie vegetale.
Così come per i medicinali, anche per i medicinali vegetali deve essere assicurata la qualità definendo il complesso processo produttivo in tutte le fasi (semina, coltivazione, raccolta, estrazione, produzione del medicinale) e il profilo del fitocomplesso testata con riferimento a specifiche appropriate. Si richiede infatti conformità alle Good Agricultural and Collection Practices (GACP), alle Good Manufacturing Practices (GMP) e ai saggi richiesti nelle monografie della farmacopea europea (6).
Gli integratori alimentari, i cosmetici e i dispositivi medici rappresentano le altre categorie di prodotti in commercio che possono contenere derivati botanici (Figura 3). Gli integratori sono definiti dalla Direttiva 2002/46/CE (7) come “prodotti alimentari, il cui scopo è quello di integrare la normale dieta e che sono fonti concentrate di nutrienti o altre sostanze con un effetto nutrizionale o fisiologico, da soli o in combinazione, commercializzati in forma dose, vale a dire sotto forma di capsule, pastiglie, compresse, pillole, etc…” (8). La principale differenza tra gli integratori e altri prodotti alimentari è la loro formula preconfenzionata, quindi si presentano in maniera molto simile ad un medicinale. All’integratore vengono attribuiti benefici per la salute e l'Agenzia europea per la sicurezza alimentare (EFSA) è responsabile della verifica della fondatezza scientifica delle indicazioni presentate. Il regolamento (CE) n. 1924/2006 (9) ha stabilito le norme dell'Unione europea sulle indicazioni nutrizionali e sulla salute, mentre il Regolamento (UE) n. 432/2012 della Commissione del 16 maggio 2012 (10) ha stabilito un elenco di indicazioni sulla salute consentite fornite sugli alimenti, in particolare prugne secche di cultivar "prugna" (Prunus domestica L.) riconosciute per contribuire alla normale funzione intestinale, Monascus purpureous (riso rosso fermentato), in particolare il costituente monacolina K, che contribuisce al mantenimento di livelli normali di lipidi e colesterolo nel sangue, etc.. (Commissione UE Health Claims 2024). Le indicazioni sono solo salutistiche e non medicinali. La commercializzazione è subordinata a “notifica”, a seguito del deposito dell’etichetta. L’EFSA ha preparato il compendio di prodotti botanici (più di 2700 specie) che contiene piante che possono rappresentare un problema per la salute se utilizzate negli alimenti o negli integratori alimentari (11).
ALTRE CATEGORIE DI PRODOTTI A BASE DI DERIVATI BOTANICI
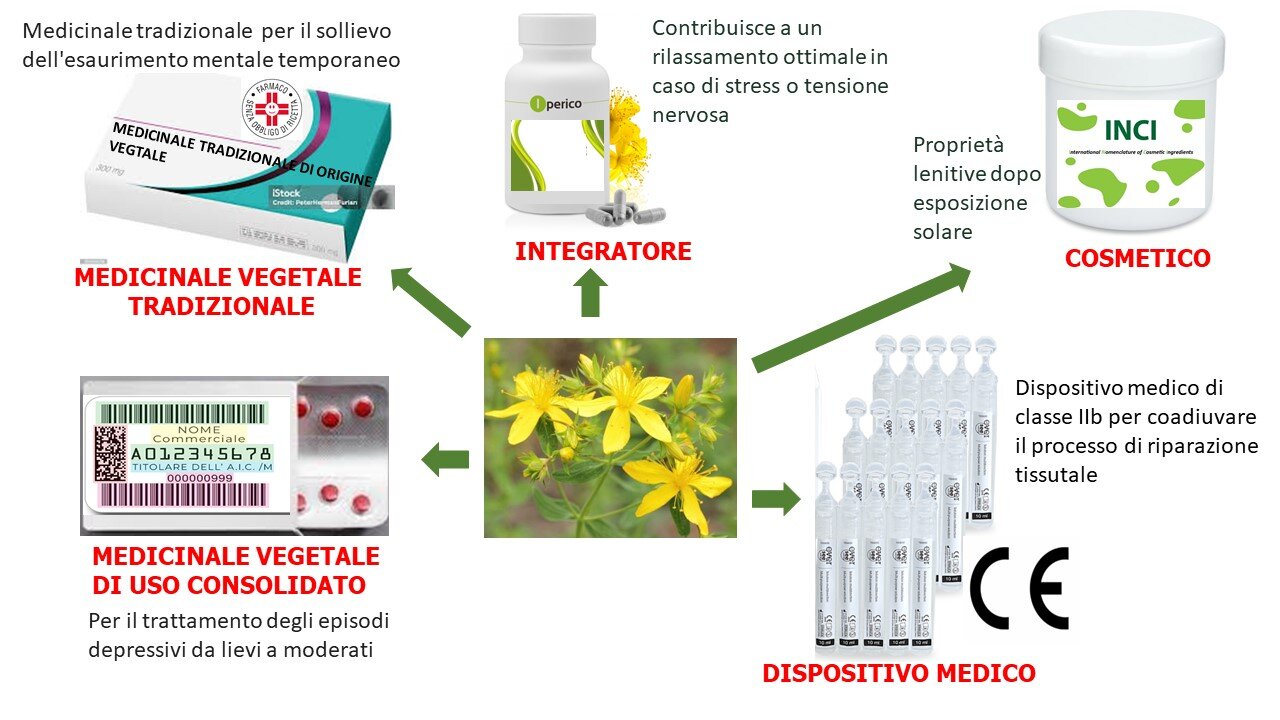
Figura 3. Diversi prodotti e loro indicazioni ottenibili dall’iperico
I prodotti vegetali sono anche ampiamente utilizzati come ingredienti per i cosmetici, legalmente definiti dalla Direttiva del Consiglio 76/768/CEE con deroga nel Regolamento (CE) n. 1223/2009 del Parlamento Europeo e del Consiglio (12). Un cosmetico è “qualsiasi sostanza o miscela destinata ad essere posta a contatto con le varie parti esterne del corpo umano (epidermide, sistema pilifero, unghie, labbra e organi genitali esterni) o con i denti e le mucose del cavo orale, allo scopo esclusivo o prevalente di pulirli, profumarli, modificarne l'aspetto, e/o correggere gli odori corporei, e/o proteggerli o mantenerli in buono stato”. L’ European Directorate for the Quality of Medicines & Health Care è l’organo europeo che contribuisce a garantire la sicurezza e la qualità dei cosmetici in Europa. L’etichetta fa fede della qualità del prodotto attraverso un elenco degli ingredienti dei cosmetici secondo denominazione INCI (Nomenclatura Internazionale degli Ingredienti Cosmetici), come richiesto dall’Articolo 33 del Regolamento (CE) n. 1223/2009 è stato stabilito nel Regolamento (UE) 2019/701 della Commissione Europea del 5 aprile 2019 (12).
Infine, negli ultimi anni il mercato dei dispositivi medici contenenti derivati botanici è cresciuto costantemente in Europa. Tre direttive principali sono state armonizzate nell'UE a partire dagli anni '90, e recentemente due nuove direttive hanno cercato di allinearsi agli sviluppi del settore negli ultimi 20 anni. Lo scopo era garantire un quadro normativo solido, trasparente e sostenibile e mantenere un elevato livello di sicurezza, sostenendo al tempo stesso l’innovazione (3).
La definizione di dispositivo medico è data nel Regolamento Europeo (UE) 2017/745: un dispositivo medico è descritto come “qualsiasi strumento, apparecchio, apparecchiatura, software, impianto, reagente, materiale o altro articolo destinato dal fabbricante ad essere utilizzato, da solo o in combinazione, su esseri umani per uno o più dei seguenti scopi medici specifici: diagnosi, prevenzione, monitoraggio, previsione, prognosi, trattamento o attenuazione di malattie, diagnosi, monitoraggio, trattamento, attenuazione o compensazione di lesioni o disabilità, indagini, sostituzione o modifica dell'anatomia o di un processo o stato fisiologico o patologico, fornendo informazioni mediante esame in vitro di campioni derivati dal corpo umano, comprese donazioni di organi, sangue e tessuti, e che non raggiunge l'azione principale prevista con mezzi farmacologici, immunologici o metabolici, nel o sul corpo umano, ma che può essere coadiuvato nella sua funzione con tali mezzi, etc.” (3).
Di conseguenza, il dispositivo medico può rivendicare proprietà e indicazioni mediche, anche se la sua azione principale prevista deve essere solo meccanica, fisica o chimica. I dispositivi medici che contengono derivati botanici sono rappresentati dalla categoria dei dispositivi basati su sostanze (farmaco o estratto botanico) ma questa sostanza deve avere una funzione accessoria e l'azione principale prevista non deve essere ottenuta con mezzi farmacologici, immunologici o metabolici (3). Tutti i dispositivi medici commercializzati nell’UE devono prima ottenere la marcatura CE, un processo che richiede un’ampia documentazione tecnica. Tutte le classi di dispositivi medici nell'UE richiedono la collaborazione con un organismo notificato, ad eccezione di quelli di classe I che possono essere autocertificati. All’interno del nuovo regolamento, i dispositivi medici costituiti da sostanze non possono più essere classificati come classe I ma almeno classe IIa (3).
Sul mercato coesistono diversi prodotti basati su piante medicinali o loro preparazioni classificati come medicinali, integratori alimentari, cosmetici e dispositivi medici. Molte agenzie sono ancora scettiche nei confronti dei medicinali vegetali e il processo di registrazione è costoso ed estremamente lento, sprecando una reale opportunità di mercato. In Figura 3 le diverse possibili categorie di prodotti contenenti derivati botanici vengono rappresentati utilizzando come esempio l’iperico.
CONCLUSIONI
Riferimenti bibliografici
- Bilia, A.R. (2015). Herbal medicinal products versus botanical-food supplements in the European market: state of art and perspectives. Natural Product Communications, 10(1), 125-31. https://pubmed.ncbi.nlm.nih.gov/25920234/
- Bilia, A.R., & Costa, M.D.C. (2021). Medicinal plants and their preparations in the European market: Why has the harmonization failed? The cases of cases of St. John's wort, valerian, ginkgo, ginseng, and green tea. Phytomedicine, 81, 153421. https://pubmed.ncbi.nlm.nih.gov/33291029/
- Bilia, A.R., Corazziari, E.S., Govoni, S., Mugelli, A., & Racchi, M. (2021). Medical Devices Made of Substances: Possible Innovation and Opportunities for Complex Natural Products. Planta Medica, 87(12-13):1110-1116. https://pubmed.ncbi.nlm.nih.gov/34359085/
- https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2004:136:0085:0090:en:PDF
- https://www.ema.europa.eu/en/human-regulatory-overview/herbal-medicinal-products/european-union-monographs-list-entries
- Bilia, A.R. (2014). Science meets regulation. Journal of Ethnopharmacology, 158, Pt B:487-94. https://www.sciencedirect.com/science/article/abs/pii/S037887411400484X
- https://eur-lex.europa.eu/eli/dir/2002/46/oj?locale=it
https://www.efsa.europa.eu/en/topics/topic/food-supplements#:~:text=Food%20supplements%20are%20intended%20to,to%20support%20specific%20physiological%20functions - https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2006:404:0009:0025:EN:PDF
- https://eur-lex.europa.eu/legal-content/IT/TXT/?uri=CELEX:32006R1924
- https://www.efsa.europa.eu/en/microstrategy/botanical-summary-report
- https://health.ec.europa.eu/document/download/47f167ec-b5db-4ec9-9d12-3d807bf3e526_en
- https://eur-lex.europa.eu/eli/reg/2017/745/oj/eng
KEYWORDS
Medicinali vegetali
Medicinali tradizionali e di uso consolidato
Normativa europea
Sicurezza

PEER REVIEWED
FITOTERAPICI
Il mercato europeo offre una vasta gamma di prodotti salutistici derivati da piante, alghe, funghi e licheni, suddivisi in categorie legali come medicinali vegetali, integratori alimentari, cosmetici e dispositivi medici. Ogni categoria segue normative specifiche, con medicinali vegetali regolati dalla Direttiva 2001/83/CE e la Direttiva 2004/24/CE, che distingue tra prodotti di uso tradizionale e consolidato. Gli integratori alimentari e i cosmetici, invece, sono regolamentati da normative europee differenti. La complessità delle normative, unita ai lunghi processi di registrazione, crea ostacoli per le aziende, rallentando l'accesso al mercato e l'innovazione, pur mantenendo standard di sicurezza e qualità.





