Cosmetic regulation
Francesco Gregorini
Responsabile Area Sicurezza Prodotto
Cepra Srl | Italia


Bio...
Francesco Gregorini:
Responsabile Area Sicurezza Prodotto
Responsabile Gestione Clienti
- Responsabile Settore Prodotto presso CEPRA srl - consulting & testing.
- Vice Presidente SICC - Società Italiana di Chimica e scienze Cosmetologiche
- Consulente abilitato per la sicurezza dei trasporti di merci pericoloso (DGSA)
- Consulente abilitato REMADE IN ITALY
- Membro Ordine dei Chimici Interprovinciale dell'Emilia Romagna
- Membro EurChem - Chimico Europeo
Antonella Ceretti:
Perito chimico industriale, consulente per la sicurezza sul lavoro, specializzata in rischio chimico e monitoraggi.
Giulia Frabboni:
Farmacista e diplomata in Scienze e Tecnologie cosmetiche, specializzata nella valutazione di sicurezza dei prodotti cosmetici
Francesca Romagnoli:
Laureata in scienze farmaceutiche applicate, specializzata nella redazione di schede di sicurezza e in classificazione ed etichettatura dei prodotti chimici
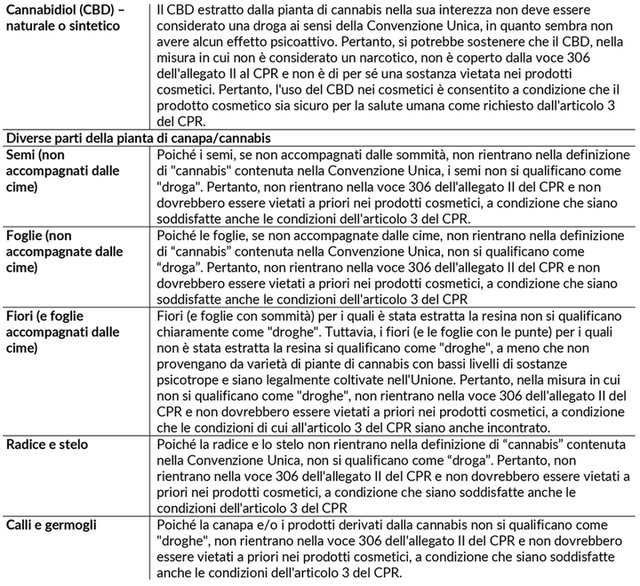
L’Unione Europea ha riconosciuto il Cannabidiolo – CBD, derivato da estratto o tintura o resina di cannabis – tra gli ingredienti per l’industria cosmetica.
Il riconoscimento del Cannabidiolo di origine naturale per usi industriali legati alla cosmesi è un passo fondamentale per lo sviluppo di questo nuovo ramo del settore nell’Unione Europea.
La cosiddetta CBD-Beauty è infatti un fenomeno in crescita in tutto il mondo.
Di seguito ripercorriamo il suo percorso da un punto di vista regolatorio.
Ai sensi dell'articolo 14, paragrafo 1, del regolamento (CE) n. 1223/2009 (1) del Parlamento europeo e del Consiglio, del 30 novembre 2009 (di seguito, "CPR"), i prodotti cosmetici non devono contenere nessuna delle sostanze vietate elencate nell'allegato II di tale regolamento.
La voce 306 dell'allegato II (Elenco delle sostanze vietate nei prodotti cosmetici) del CPR si riferisce a "Narcotici, naturali e sintetici: tutte le sostanze elencate nelle tabelle I e II della Convenzione Unica sugli stupefacenti del 1961"(2).
L'articolo 1 ("Definizioni") [della Convenzione del 1961], definisce "droga" come "qualsiasi” sostanza delle tabelle I e II, naturale o sintetica.
L'elenco delle droghe nella Tabella I comprende: CANNABIS, CANNABIS RESIN ed ESTRATTI e TINTURE DI CANNABIS.
L'articolo 1 della Convenzione del 1961 definisce questi termini come segue:
«b) “Cannabis": si intendono le sommità fiorite o fruttifere della pianta di cannabis (esclusi i semi e le foglie se non accompagnate dalle sommità) dalle quali non è stata estratta la resina; con qualsiasi nome possano essere designati.
c) "Pianta di cannabis”: indica qualsiasi pianta del genere Cannabis,
d) "Resina di cannabis": la resina separata, grezza o purificata, ottenuta dalla pianta di cannabis.».
Nel 2019 il “Working Group on Cosmetic Products” della Commissione Europea ha condiviso un documento con una proposta di interpretazione della entry 306/II del CPR.
Riguardo il CBD, viene sottolineato che questo non è incluso direttamente nelle Tabelle I e II Convenzione Unica sugli stupefacenti del 1961 e quindi non dovrebbe rientrare nella proibizione prevista dalla entry 306/II.
Per tale motivo le prime interpretazioni hanno portato e concludere che il CBD sintetico fosse ammesso, mentre quello naturale (ottenuto da estratti, tinture o resine della Cannabis) rientrasse nello scopo della Convenzione e quindi della entry 306/II del CPR.
Nel novembre 2020, la sentenza della Corte di giustizia europea sul caso Kanavape (causa C-663/18) (3) ha concluso che il CBD, non dovrebbe essere considerato una droga ai sensi della Convenzione Unica delle Nazioni Unite sugli stupefacenti del 1961, anche nei casi in cui il CBD è estratto dall’intera pianta di canapa (comprese foglie e fiori), poiché il CBD, secondo il CGUE, “non sembra avere alcun effetto psicoattivo riconosciuto allo stato attuale delle conoscenze scientifiche”.
A seguito di tale sentenza e delle richieste dell’EIHA - l’associazione europea per la canapa industriale – sono stati eliminati i divieti sulla Cannabis Sativa L. (limitata sotto il rif. II/306: stupefacente) e di integrare nuove voci INCI sul database CosIng (4).
Infatti, è stata introdotta la voce dedicata al Cannabidiolo (CBD) (CANNABIDIOL – derivato da estratto o tintura o resina di cannabis).
In termini pratici, questo significa che ora, nell’UE, non solo gli estratti di foglie possono essere usati in cosmetica, ma anche il CBD naturale (finora, nel database era previsto solo l’uso del CBD sintetico).
Altre: BENZYL SALICYLATE (CAS 118-58-1), BENZOPHENONE (CAS 119-61-9), TRICLOSAN (CAS 3380-34-5), TRICLOCARBAN (CAS 101-20-2), KOJIC ACID (CAS 501-30-4), GENISTEIN (CAS 446-72-0), DAIDZEIN (CAS 486-66-8), 4-Methylbenzylidene Camphor (CAS 36861-47-9 / 38102-62-4)
Tetraidrocannabinolo (THC) come contaminante
Per quanto riguarda la presenza di sostanze vietate (come nel caso del THC) nei prodotti cosmetici, si applica l'articolo 17 del CPR.
La presenza non intenzionale di una piccola quantità di THC potrebbe essere accettata nelle circostanze stabilite (inevitabilità tecnica) a condizione che il prodotto sia sicuro per la salute umana come richiesto dall'articolo 3 del CPR e che per qualificarsi come CBD la sostanza deve corrispondere alla definizione chimica (5) e non deve causare effetti psicotropi nell'uomo.
È utile segnalare che al momento non è stato normato un limite di THC come impurezza, ma questo è oggetto di discussione a livello della Commissione.
La Corte di giustizia ha rilevato al punto 72 della sentenza che, secondo gli elementi del fascicolo, la varietà di cannabis da cui è stata estratta la sostanza CBD aveva un contenuto di THC non superiore allo 0,2%.
REACh e CLP
Al fine di una completa valutazione regolatoria, è utile sottolineare che a queste materie prime possono applicarsi i regolamenti REACh e CLP.
I criteri di classificazione del CLP devono essere applicati sia al CBD (sintetico/naturale) che eventualmente ai diversi estratti. Si segnala che per il CBD (CAS 13956-29-1) diverse classificazioni presentate nell’inventario ECHA indicano la classificazione come H361 (reprotossico di cat. 2) (6).
Da un punto di vista REACh devono essere considerati gli obblighi di registrazione del CBD sintetico (in caso di produzione o importazione > 1 tonn / anno) e del CBD naturale nel caso in cui i criteri di esenzione dell’allegato V del REACH non siano applicabili.



