FOCUS SULL’ASPETTO NUTRIZIONALE DI ALCUNI MACRO E MICRONUTRIENTI CORRELATO ALLE FACOLTÀ COGNITIVE
(2a PARTE)

Nel precedente numero abbiamo discusso l’importanza dell’integrazione di β-carotene e di creatina per il miglioramento delle funzioni cognitive. In questa edizione continuiamo nello stesso ambito analizzando l’effetto di altri tipi di supplementazione.
INTRODUZIONE
L'assunzione di cibo influisce sulla funzione cerebrale (1) ma permangono lacune nelle nostre conoscenze sugli effetti comportamentali di molti nutrienti, in particolare negli anziani (2). Vi è un notevole interesse per i potenziali benefici degli integratori alimentari (3) con alcuni risultati incoraggianti, ad esempio con le vitamine del gruppo B (4), le vitamine C ed E (5) ed il folato (6). Un micronutriente che ha ricevuto meno attenzione è lo zinco (Zn), un oligoelemento non tossico, essenziale per molte attività biochimiche e funzioni fisiologiche (7, 8).
Lo zinco, in quanto antiossidante, è importante per il sistema immunitario, riproduttivo e nervoso centrale ed è presente in molte aree del cervello, in particolare nell'ippocampo e nell'amigdala (9), influenzando la struttura e la funzione cerebrale (10, 11, 12). Può essere assunto solo attraverso la dieta (le fonti principali sono carne e pesce) e la carenza di zinco può portare ad una guarigione più lenta delle ferite fino a uno sviluppo fisico e cognitivo ritardato (7). Diversi studi condotti sulla supplementazione di zinco in neonati e donne incinte hanno dimostrato benefici in termini di salute fisica, tasso di crescita e sviluppo cognitivo dei neonati e dei bambini nati dalle madri che assumono integratori (9, 13, 14). Lo studio di Briefel ha riferito che solo il 44% degli adulti di età superiore ai 70 anni aveva un apporto adeguato di zinco (15) e quello di Prasad ha posto in evidenza che, gli individui con età >65 anni con carenza di Zn presentavano un problema clinico significativo (16). Una ricerca successiva ha esaminato 260 spagnoli di età compresa tra 65-90 anni e ha dimostrato che i migliori punteggi cognitivi erano associati ai soggetti che mantenevano una dieta ricca e variegata, con conseguente intake di zinco suggerendo come questo possa influenzare le funzioni cognitive (17). Tuttavia, gli autori riconoscono che il loro progetto non è stato in grado di stabilire il rapporto causa-effetto o di escludere possibili fattori confondenti. Test cognitivi sono stati eseguiti su 2166 adulti di età compresa tra 61 e 87 anni, metà dei quali aveva ricevuto integratori di zinco (80 mg/giorno) per diversi anni (18). Non sono state rilevate differenze significative tra i gruppi, ma gli autori hanno evidenziato diverse limitazioni al loro studio, compresa la mancanza di misure cognitive prima della supplementazione e la perdita del 40% dei partecipanti.
Uno studio del 2001 ha avuto valutato il livello di zinco degli europei sani, anziani e di mezza età, e ha indagato gli effetti della supplementazione sul funzionamento cognitivo (19). Si noti che, se il campione non fosse carente di zinco, potrebbero esserci dei vantaggi nel consumo di alcuni nutrienti a livelli superiori al fabbisogno medio. Inoltre, è necessario stabilire che le dosi sovrannaturali di zinco non abbiano effetti avversi. Ciò è di vitale importanza a causa del crescente uso di integratori alimentari, anche tra gli anziani, e della crescente disponibilità di alimenti specificamente fortificati con zinco (20).
Un ulteriore progetto ha previsto uno studio di intervento in uomini e donne randomizzato, doppio cieco, placebo-controllato con assegnazione a uno dei tre trattamenti: placebo, 15 mg Zn/d o 30 mg Zn/d per 6 mesi. Prima dell'intervento e dopo 3 e 6 mesi (prima dell’inizio dello studio, dopo 3 mesi e 6 medi) di integrazione con zinco sono stati effettuati esami clinici e psicologici, nonché prelevati campioni di sangue e urina. La funzione cognitiva è stata valutata dalla batteria di test neuropsicologici automatizzati di Cambridge (CANTAB) (21, 22).
EFFETTI DELLA SUPPLEMENTAZIONE DI ZINCO SULLA FUNZIONE COGNITIVA IN ADULTI SANI DI ETÀ MEDIA ED ANZIANI
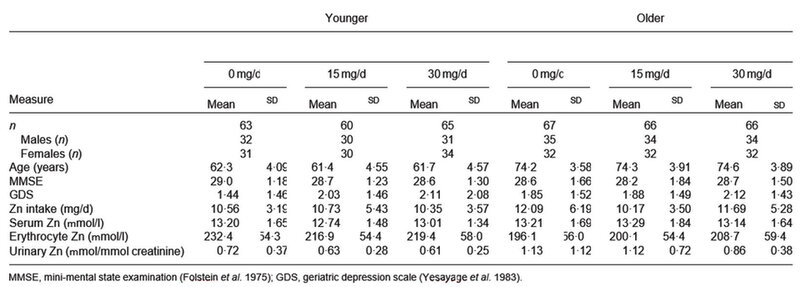
Figura 3. Numero di partecipanti giovani e anziani assegnati a ciascuno dei tre trattamenti con Zn (0, 15 e 30 mg/d), con età, punteggi dei test di screening e livello di Zn basale (23)
La supplementazione di Zn (0, 15 o 30 mg/d) è stata somministrata come gluconato di zinco, sottoforma di due compresse allo stesso orario ogni giorno (solitamente dopo colazione) per 6 mesi. La funzione cognitiva è stata valutata in laboratorio al basale (prima del completamento) e dopo 3 e 6 mesi, utilizzando diverse versioni (parallele) dei test CANTAB in ogni occasione. I partecipanti hanno digiunato per 12 ore prima che campioni di sangue e urina fossero prelevati.
La presentazione dello stimolo è stata controllata da un computer e le risposte sono state ottenute utilizzando uno schermo sensibile al tatto e anche un grande touch-pad per alcuni dei test, posizionato a 0,15 m dallo schermo. I partecipanti erano seduti a circa 0,5 m dallo schermo e hanno risposto a una serie di input sullo schermo toccando ciascuno con il dito indice della loro mano preferita non appena appariva una croce. Se la loro risposta fosse stata esatta, si sarebbe presentato un feedback uditivo, la croce scompariva e la successiva veniva presentata dopo un piccolo ritardo. Dopo aver completato con successo il primo step (dieci croci), venivano effettuati i principali test cognitivi, sempre nello stesso ordine.
In sintesi, i partecipanti di entrambe le fasce d'età sono risultati ben allineati tra i tre trattamenti sulle misure al basale (Figura 3). Gli adulti più giovani differivano dagli adulti più anziani solo nei livelli di zinco eritrocitario (più elevato) e nelle urine (più basso). Per lo zinco sia sierico che urinario, si sono verificate interazioni altamente significative tra trattamento e tempo. Le variazioni tra il periodo di riferimento (es. il mese 0) e i mesi 3 e 6 (che erano simili) per lo zinco sierico sono state le seguenti: diminuzione nel gruppo placebo di 0,25 mmol/l, aumento nel gruppo 15 mg/giorno di 1,02 mmol/l, aumento di 2,12 mmol/l nel gruppo 30 mg/giorno. Queste le variazioni corrispondenti per lo zinco urinario: diminuzione di 0,10 mmol/mmol creatinina (placebo), aumento di 0,3 mmol/mmol creatinina (15 mg/d) e di 0,44 mmol/mmol creatinina (30 mg/d). Le tendenze per lo zinco eritrocitario erano simili (23,15 + 7,14 e +8,16 mmol/l, rispettivamente), ma il tempo di interazione in questo caso non ha raggiunto la significatività. Questi dati dimostrano che esistono conseguenze biologiche significative a seguito della supplementazione di zinco. Per tutte e tre le misure, l'interazione tra età, trattamento e tempo non era significativa, indicando che gli adulti giovani ed anziani reagivano similmente alla supplementazione in termini biologici.
Riassumendo i risultati principali, l'assunzione di zinco all'inizio del programma era simile negli adulti più giovani e più anziani (età media rispettivamente di 62 e 74 anni), ma lo zinco degli eritrociti era maggiore, mentre quello urinario era inferiore negli adulti più giovani rispetto agli anziani, senza differenze di età per quanto riguarda quello sierico. La supplementazione era efficace in quanto i livelli di zinco nel siero e nelle urine aumentava, di più per la dose elevata (30 mg/d) che per la dose inferiore (15 mg/d), con tendenze simili per lo zinco eritrocitario. Questi effetti biologici della supplementazione di zinco non differiscono tra adulti più giovani e anziani. Per le misure cognitive, gli adulti più giovani superavano gli adulti più anziani in tutti i test. Tuttavia, c'erano solo due interazioni significative che indicano effetti della supplementazione di zinco sulla funzione cognitiva, con un effetto benefico (solo a 3 mesi) dei 15 e 30 mg/d per gli errori SWM(spatial working memory), e un effetto dannoso dei 15 mg/d per la latenza MTS (mean correct latency).
Ulteriori analisi hanno dimostrato che questi risultati erano gli stessi per:
- uomini e donne;
- individui con un livello di funzionamento inferiore o superiore (in base ai punteggi MMSE, Mini Mental State Examination);
- soggetti senza/istruzione primaria, secondaria e terziaria;
- individui con livelli di zinco sierico più bassi o più elevati.
Lo zinco urinario era più alto negli adulti anziani che in quelli giovani, suggerendo cambiamenti nel metabolismo dello zinco con l'età. Lo zinco eritrocitario risultava diminuito con l'età a differenza di quello sierico.
E’ importante notare che si sono verificati pochi effetti significativi sulla funzione cognitiva - delle otto misure, una ha mostrato un effetto benefico di breve durata e un’altra ha provocato un effetto dannoso a 15 ma non a 30 mg/d.
E’ probabile che i partecipanti non fossero sufficientemente deficienti in zinco (sia in termini di assunzione o livelli sierici) per ottenere molto beneficio dagli integratori. Certamente, i soggetti erano un campione altamente selezionato, con il 49 % dei primi 842 volontari esclusi dallo studio di screening sulla base di deficit cognitivo, depressione, condizioni patologiche, farmaci e così via. Non sappiamo quindi se i risultati attuali interessino la metà meno sana della popolazione esclusa dallo studio. Rimane quindi possibile che i risultati della supplementazione di zinco sulla funzione cognitiva siano più positivi in altre popolazioni più vulnerabili (ad esempio, anziani con problemi cognitivi o ricoverati).
Sebbene i risultati abbiano rivelato l'evidenza di un solo effetto benefico dello zinco sulla funzione cognitiva, hanno anche mostrato un solo effetto avverso. Questo dato è rassicurante perché gli anziani possono assumere integratori a base di zinco per ragioni non cognitive, anche in considerazione della crescente disponibilità e del l'uso di alimenti arricchiti e di integratori alimentari.
ROBERTO CANNATARO1 ANTONIO GRIMALDI2
1. Co-direttore master Sports Analytics - Unical | CSO, Galascreen Laboratories - Italia, DBSS International SAS | Colombia
Membro del COMITATO SCIENTIFICO di NUTRA HORIZONS
2. Biologo Nutrizionista
ROBERTO CANNATARO1
ANTONIO GRIMALDI2
1. Direttore master Sports Analytics - Unical | CSO, Galascreen Laboratories - Italia |
DBSS International SAS | Colombia
Membro del COMITATO SCIENTIFICO di NUTRA HORIZONS
2. Biologo nutrizionista


Bio...


Roberto Cannataro
Laureato in Ingegneria Chimica, Scienze e Tecnologie Alimentari e Scienza della Nutrizione Umana, opera come nutrizionista in 14 città diverse, ha collaborato e collabora con varie realtà sportive professionistiche. E' consulente per lo sviluppo di integratori alimentari dall’idea al reperimento materie prima, dall’impiantistica al customer advertising.
E' il referente nutrizione dei Ediermes e per loro dirige un Master di Nutrizione ed integrazione nello sport; all’Università della Calabria co-dirige il Master di primo livello “Sport Analytics”.
E' CSO di Galascreen Laboratories e Vita Vegan Excellence.
Faccio parte di vari comitati scientifici e reviewer board.
Antonio Grimaldi
Biologo Nutrizionista, consegue la Laurea Magistrale in Scienza della Nutrizione Umana il 6 Ottobre 2017 con votazione di 110 e lode, presso il Dipartimento di Farmacia e Scienza della Salute e della Nutrizione dell’Università della Calabria.
Iscritto all’Ordine dei Biologi dal 2017, nel l’Aprile 2024 ha conseguito il master di 1 livello in “Sport scientist” presso l’Università della Calabria.
A Giugno 2024 ha conseguito il titolo di Antropometrista Isak - livello 1.
Ad oggi collabora con lo studio Monea (Taurianova), con lo studio osteo-equipe (Roma), con la palestra new Energy (Padova).
La vitamina D è coinvolta in molteplici attività nel nostro organismo, tra cui l'apoptosi cellulare, lo stress ossidativo, l'infiammazione e l'eccitotossicità (24). Viene metabolizzata nel fegato in 25-idrossivitamina D (25(OH)D) (25). La forma idrossilata sul carbonio 25 viene quindi convertita in 1,25-diidrossivitamina D (1,25[OH]2) e la conversione è regolata dall'ormone paratiroideo e dai livelli di magnesio (26). Il 25(OH)D sierico viene spesso utilizzato per valutare lo stato della vitamina D nel corpo. Nonostante gli alimenti arricchiti in vitamina D e l'integrazione dietetica, diversi studi hanno evidenziato che una grande percentuale di adulti assume vitamina D in maniera inferiore rispetto ai requisiti medi stimati (EAR) (26) e circa il 30% dei soggetti con età >65 anni ha un 25(OH)D sierico inferiore a 50 nmol/l (27).
Il magnesio, il secondo catione intracellulare più abbondante, svolge un ruolo critico in numerose reazioni biologiche tra cui la produzione di energia, la sintesi proteica, il metabolismo degli acidi nucleici (28, 29, 30, 31, 32), il mantenimento delle funzioni delle membrane muscolari e nervose e la partecipazione alla trasmissione neurochimica e alla trasmissione nervosa (33). Un basso apporto di magnesio è stato collegato al rischio di sindrome metabolica, diabete di tipo 2, malattie cardiovascolari (34) e diminuzione delle capacità cognitive (29, 31). Il magnesio svolge un ruolo importante nel metabolismo della vitamina D ed una carenza di questo catione comporta livelli ridotti di 1,25[OH] 2D che, a sua volta, può portare ad un incremento dell’assorbimento intestinale di magnesio (32).
Precedenti studi osservazionali hanno suggerito che le carenze di vitamina D e magnesio erano associate a deterioramento cognitivo e rischio di demenza (29, 30, 31, 33).
In particolare, uno studio ha utilizzato i dati del sondaggio continuo NHANES da due cicli, condotti tra il 2011 e il 2014 in cui è stato condotto un test della funzione cognitiva tra gli anziani. Il NHANES è un sondaggio progettato per valutare la salute e la nutrizione in un campione rappresentativo della popolazione a livello nazionale. La funzione cognitiva è stata valutata tra i partecipanti di età pari o superiore a 60 anni utilizzando il DSST, descritto in precedenza (34). In breve, il DSST è una misura consolidata e convalidata della prestazione cognitiva che valuta la funzione esecutiva e la velocità di elaborazione. È un test fornito su carta e completato utilizzando una matita per valutare la prestazione psicomotoria. Contiene una tabella con numeri (1-9) e simboli corrispondenti, nonché una sezione di test di numeri con caselle vuote in cui ai partecipanti viene chiesto di riempire le caselle vuote con i simboli corrispondenti ai numeri forniti. Il punteggio è il numero totale di simboli corretti disegnati entro 2 minuti, con un punto assegnato per una risposta corretta e un punteggio massimo di 133. Poiché non esiste una soglia ben definita del punteggio DSST per rilevare il deterioramento cognitivo, il quartile non ponderato più basso nella popolazione dello studio (DSST ≤ 34) è stato utilizzato per definire il deterioramento cognitivo o la bassa funzione cognitiva, in linea con i metodi utilizzati in precedenza (35). I soggetti con punteggi DSST > 34 sono stati considerati non compromessi cognitivamente.
I soggetti con compromissione cognitiva consumavano meno calcio e magnesio, avevano un apporto energetico totale inferiore ed erano meno propensi ad assumere integratori alimentari rispetto a quelli senza compromissione cognitiva.
L’associazione positiva tra assunzione di magnesio e punteggio DSST è apparsa più forte tra le donne, tra i bianchi non ispanici, tra soggetti moderatamente o molto attivi fisicamente e i soggetti con un livello sufficiente di vitamina D, sebbene le interazioni non fossero statisticamente significative. I risultati, dall'analisi congiunta, suggeriscono che una combinazione di assunzione sufficiente di magnesio (ad esempio ≥311 mg/giorno paragonabile alla dose giornaliera raccomandata (RDA): 400 mg per gli uomini; 310 mg per le donne) e un adeguato intake di vitamina D (≥50 nmol/L) era associato a un punteggio DSST più alto in questa popolazione anziana. Inoltre, i dati hanno suggerito che una concentrazione sierica di 25(OH)D tra 81-98 nmol/l potrebbe indicare un livello ottimale per ridurre il rischio di deterioramento cognitivo negli anziani.
In accordo con ricerche precedenti (26, 27, 36), lo studio ha rilevato che un maggiore apporto di magnesio totale era associato a un punteggio DSST significativamente più alto e a ridotte probabilità di compromissione cognitiva. In particolare, è stato rilevato che i soggetti con sufficiente apporto di vitamina D e sufficiente assunzione totale di magnesio avevano i maggiori incrementi nel punteggio DSST. I risultati sono biologicamente plausibili perché lo stato corporeo di magnesio e vitamina D e la loro interazione sono fondamentali per il mantenimento cognitivo negli anziani.
ASSOCIAZIONE TRA ASSUNZIONE DI MAGNESIO E STATO DI VITAMINA D CON FUNZIONE COGNITIVA NEGLI ANZIANI
Alcuni componenti dietetici si accumulano selettivamente nel cervello dove svolgono importanti funzioni fisiologiche. Questi includono gli acidi grassi omega-3 (ω-3FA) (37, 38), carotenoidi xantofilli (pigmenti vegetali contenenti ossigeno) e vitamina E (39, 40, 41). Precedenti lavori osservazionali e interventistici che hanno esaminato separatamente gli effetti di questi nutrienti sulla funzione cognitiva hanno prodotto risultati promettenti, seppur contrastanti (39, 42, 43).
Da questo studio (clinico randomizzato) emerge che l'integrazione per 24 mesi con 430 mg di DHA, 90 mg di EPA, 10 mg di luteina, 2 mg di zeaxantina, 10 mg di meso -zeaxantina e 15 mg di vitamina E (d -α-tocoferolo) è efficace nel migliorare le prestazioni cognitive, in particolare la memoria di lavoro negli anziani cognitivamente sani. L’attività cognitiva globale è stata valutata utilizzando la versione 7.1 del MoCA (44) e il modulo di registrazione RBANS A (45) allo screening e al follow-up a 12 e 24 mesi (eseguito da RP). Il MoCA è un breve questionario di screening cognitivo (10 minuti) di 30 domande utilizzato per rilevare il deterioramento cognitivo. Valuta molteplici domini cognitivi tra cui abilità visuo-spaziali, funzione esecutiva, fluenza fonemica, attenzione, richiamo immediato e ritardato, linguaggio e orientamento. Un punteggio ≥26 su 30 era auspicabile per l'arruolamento. L'RBANS è uno strumento diagnostico fondamentale per rilevare il declino o il miglioramento cognitivo, richiede circa 30 minuti per essere somministrato e valuta la memoria immediata, l'abilità visuo-spaziale, il linguaggio, l'attenzione e la memoria ritardata utilizzando 12 sottotest. I punteggi di ciascun dominio vengono sommati per determinare un punteggio indice/scala totale. I punteggi dell'indice RBANS sono scalati in modo metrico, con una media di 100 e una deviazione standard di 15 per ogni fascia d'età. Un punteggio di 100 su una qualsiasi di queste misure equivale alla prestazione media di individui di età simile. I punteggi di 85 e 115 corrispondono rispettivamente a 1 deviazione standard al di sotto e al di sopra della media, mentre i punteggi di 70 e 130 sono 2 deviazioni standard al di sotto e al di sopra della media.
Dopo 24 mesi di integrazione, gli individui nell'intervento attivo hanno mostrato miglioramenti nella memoria di lavoro. Sono stati registrati anche miglioramenti nell'attenzione e nell’attività cognitiva globale. Con specifico riferimento alla memoria di lavoro, gli individui nel gruppo attivo hanno commesso significativamente meno errori nelle fasi finali e combinate del compito SWM (vedi note) rispetto ai soggetti del gruppo placebo. Da notare che i cambiamenti osservati nelle concentrazioni di carotenoidi nei tessuti e nel siero e di ω-3FA nel plasma erano direttamente correlati ai miglioramenti osservati in questo compito di memoria di lavoro. Nello studio, la codifica e il recupero delle informazioni erano comparabili tra i gruppi attivi e placebo durante un compito di memoria di lavoro con pochi stimoli (ad esempio, fase 4 del compito SWM in cui l'individuo doveva localizzare 4 token). È importante notare che, all'aumentare del carico cognitivo (ad esempio, da 4 a 6 token e da 6 a 8 token), gli individui nell'intervento attivo hanno ottenuto risultati migliori rispetto agli individui nel gruppo placebo, con prestazioni migliori nella fase 8 e nelle fasi sommate in cui il carico cognitivo era al massimo. Ciò suggerisce che la capacità di memoria di lavoro degli individui nel gruppo attivo è stata modificata favorevolmente nel tempo e che questi cambiamenti positivi possono essere attribuiti all'arricchimento di ω-3FA e carotenoidi, dato che l'entità del cambiamento nella cognizione era correlata all'entità del cambiamento nei livelli nutrizionali e dato che questi nutrienti hanno precedentemente dimostrato di essere neuroprotettivi (46). In termini di rilevanza clinica, i miglioramenti osservati nella memoria di lavoro possono tradursi in benefici pratici per le funzioni quotidiane. Mentre gli individui che hanno ricevuto l'intervento attivo hanno risposto positivamente all'integrazione di ω-3FA e carotenoidi, non sono stati osservati miglioramenti nel d -⍺-tocoferolo.
L'INTEGRAZIONE DI ACIDI GRASSI OMEGA-3, CAROTENOIDI E VITAMINA E MIGLIORA LA MEMORIA DI LAVORO NEGLI ANZIANI
Riferimenti bibliografici
NOTE:
Spatial working memory. I partecipanti dovevano cercare tra una serie di caselle rosse sullo schermo per raccogliere i gettoni blu nascosti all'interno delle caselle e usarli per riempire una colonna vuota sul lato destro dello schermo. Ogni casella è stata usata una volta per nascondere un token, quindi il numero totale di token blu trovati in ogni prova era uguale al numero totale di caselle rosse visualizzate sullo schermo.
Matching to sample visual search. In questo compito, i partecipanti hanno visto un modello astratto composto da quattro elementi colorati al centro dello schermo. Poco dopo, due, quattro o otto modelli simili sono apparsi in un cerchio di scatole che circondavano il modello originale. Ai partecipanti è stato chiesto di rilasciare il touch-pad e toccare il singolo modello che corrispondeva esattamente al modello nel centro dello schermo
BIBLIOGRAFIA
- Fernstrom JD. Can nutrient supplements modify brain function? Am J Clin Nutr. 2000 Jun;71(6 Suppl):1669S-75S. doi: 10.1093/ajcn/71.6.1669S. https://pubmed.ncbi.nlm.nih.gov/10837313/
- Mocchegiani E, Bertoni-Freddari C, Marcellini F, Malavolta M. Brain, aging and neurodegeneration: role of zinc ion availability. Prog Neurobiol. 2005 Apr;75(6):367-90. doi: 10.1016/j.pneurobio.2005.04.005. https://pubmed.ncbi.nlm.nih.gov/15927345/
- McDaniel MA, Maier SF, Einstein GO. "Brain-specific" nutrients: a memory cure? Nutrition. 2003 Nov-Dec;19(11-12):957-75. doi: 10.1016/s0899-9007(03)00024-8. https://pubmed.ncbi.nlm.nih.gov/14624946/
- Calvaresi E, Bryan J. B vitamins, cognition, and aging: a review. J Gerontol B Psychol Sci Soc Sci. 2001 Nov;56(6):P327-39. doi: 10.1093/geronb/56.6.p327. https://pubmed.ncbi.nlm.nih.gov/11682586/
- Masaki KH, Losonczy KG, Izmirlian G, Foley DJ, Ross GW, Petrovitch H, Havlik R, White LR. Association of vitamin E and C supplement use with cognitive function and dementia in elderly men. Neurology. 2000 Mar 28;54(6):1265-72. doi: 10.1212/wnl.54.6.1265. https://pubmed.ncbi.nlm.nih.gov/10746596/
- Joyal CC, Lalonde R, Vikis-Freibergs V, Botez MI. Are age-related behavioral disorders improved by folate administration? Exp Aging Res. 1993 Oct-Dec;19(4):367-76. doi: 10.1080/03610739308253944. https://pubmed.ncbi.nlm.nih.gov/8281977/
- Hambidge M. Human zinc deficiency. J Nutr. 2000 May;130(5S Suppl):1344S-9S. doi: 10.1093/jn/130.5.1344S. https://pubmed.ncbi.nlm.nih.gov/10801941/
- María J Salgueiro, Marcela Zubillaga, Alexis Lysionek, María I Sarabia, Ricardo Caro, Tomás De Paoli, Alfredo Hager, Ricardo Weill, José Boccio, Zinc as an essential micronutrient: A review, Nutrition Research, Volume 20, Issue 5, 2000, Pages 737-755, https://www.sciencedirect.com/science/article/pii/S0271531700001639
- Takeda A. Movement of zinc and its functional significance in the brain. Brain Res Brain Res Rev. 2000 Dec;34(3):137-48. doi: 10.1016/s0165-0173(00)00044-8. https://pubmed.ncbi.nlm.nih.gov/11113504/
- Black MM. Zinc deficiency and child development. Am J Clin Nutr. 1998 Aug;68(2 Suppl):464S-469S. doi: 10.1093/ajcn/68.2.464S. https://pubmed.ncbi.nlm.nih.gov/9701161/
- Sandstead HH. Causes of iron and zinc deficiencies and their effects on brain. J Nutr. 2000 Feb;130(2S Suppl):347S-349S. doi: 10.1093/jn/130.2.347S. https://pubmed.ncbi.nlm.nih.gov/10721903/
- Sandstead HH. Zinc is essential for brain development and function. J Trace Elem Exp Med 16, 165 – 173, 2003. https://onlinelibrary.wiley.com/doi/abs/10.1002/jtra.10042
- Bhatnagar S, Taneja S. Zinc and cognitive development. Br J Nutr. 2001 May;85 Suppl 2:S139-45. doi: 10.1079/bjn2000306. https://pubmed.ncbi.nlm.nih.gov/11509102/
- Salgueiro MJ, Zubillaga MB, Lysionek AE, Caro RA, Weill R, Boccio JR. The role of zinc in the growth and development of children. Nutrition. 2002 Jun;18(6):510-9. doi: 10.1016/s0899-9007(01)00812-7. https://pubmed.ncbi.nlm.nih.gov/12044825/
- Briefel RR, Bialostosky K, Kennedy-Stephenson J, McDowell MA, Ervin RB, Wright JD. Zinc intake of the U.S. population: findings from the third National Health and Nutrition Examination Survey, 1988-1994. J Nutr. 2000 May;130(5S Suppl):1367S-73S. doi: 10.1093/jn/130.5.1367S. https://pubmed.ncbi.nlm.nih.gov/10801945/
- Prasad AS, Fitzgerald JT, Hess JW, Kaplan J, Pelen F, Dardenne M. Zinc deficiency in elderly patients. Nutrition. 1993 May-Jun;9(3):218-24. https://pubmed.ncbi.nlm.nih.gov/8353362/
- Ortega RM, Requejo AM, Andrés P, López-Sobaler AM, Quintas ME, Redondo MR, Navia B, Rivas T. Dietary intake and cognitive function in a group of elderly people. Am J Clin Nutr. 1997 Oct;66(4):803-9. doi: 10.1093/ajcn/66.4.803. https://pubmed.ncbi.nlm.nih.gov/9322553/
- Yaffe K, Clemons TE, McBee WL, Lindblad AS; Age-Related Eye Disease Study Research Group. Impact of antioxidants, zinc, and copper on cognition in the elderly: a randomized, controlled trial. Neurology. 2004 Nov 9;63(9):1705-7. doi: 10.1212/01.wnl.0000142969.19465.8f. https://pubmed.ncbi.nlm.nih.gov/15534261/
- Kiely M, Flynn A, Harrington KE, Robson PJ, O'Connor N, Hannon EM, O'Brien MM, Bell S, Strain JJ. The efficacy and safety of nutritional supplement use in a representative sample of adults in the North/South Ireland Food Consumption Survey. Public Health Nutr. 2001 Oct;4(5A):1089-97. doi: 10.1079/phn2001190. https://pubmed.ncbi.nlm.nih.gov/11820922/
- Canter PH, Ernst E. Herbal supplement use by persons aged over 50 years in Britain: frequently used herbs, concomitant use of herbs, nutritional supplements and prescription drugs, rate of informing doctors and potential for negative interactions. Drugs Aging. 2004;21(9):597-605. doi: 10.2165/00002512-200421090-00004. https://pubmed.ncbi.nlm.nih.gov/15260514/
- Sahakian BJ, Owen AM. Computerized assessment in neuropsychiatry using CANTAB: discussion paper. J R Soc Med. 1992 Jul;85(7):399-402. https://pubmed.ncbi.nlm.nih.gov/1629849/
- V Vonder Haar C, Peterson TC, Martens KM, Hoane MR. Vitamins and nutrients as primary treatments in experimental brain injury: Clinical implications for nutraceutical therapies. Brain Res. 2016 Jun 1;1640(Pt A):114-129. doi: 10.1016/j.brainres.2015.12.030. https://pubmed.ncbi.nlm.nih.gov/26723564/
- Maylor EA, Simpson EE, Secker DL, Meunier N, Andriollo-Sanchez M, Polito A, Stewart-Knox B, McConville C, O'Connor JM, Coudray C. Effects of zinc supplementation on cognitive function in healthy middle-aged and older adults: the ZENITH study. Br J Nutr. 2006 Oct;96(4):752-60. https://pubmed.ncbi.nlm.nih.gov/17010236/
- DeLuca HF. Overview of general physiologic features and functions of vitamin D. Am J Clin Nutr. 2004 Dec;80(6 Suppl):1689S-96S. doi: 10.1093/ajcn/80.6.1689S. https://pubmed.ncbi.nlm.nih.gov/15585789/
- Health UDo, Services H (2017) Dietary guidelines for Americans 2015–2020. Skyhorse Publishing Inc. https://health.gov/sites/default/files/2019-09/2015-2020_Dietary_Guidelines.pdf
- Liu X, Baylin A, Levy PD. Vitamin D deficiency and insufficiency among US adults: prevalence, predictors and clinical implications. Br J Nutr. 2018 Apr;119(8):928-936. doi: 10.1017/S0007114518000491. https://pubmed.ncbi.nlm.nih.gov/29644951/
- Costello R, Wallace TC, Rosanoff A. Magnesium. Adv Nutr. 2016 Jan 15;7(1):199-201. doi: 10.3945/an.115.008524. https://pubmed.ncbi.nlm.nih.gov/26773023/
- Cherbuin N, Kumar R, Sachdev PS, Anstey KJ. Dietary Mineral Intake and Risk of Mild Cognitive Impairment: The PATH through Life Project. Front Aging Neurosci. 2014 Feb 4;6:4. doi: 10.3389/fnagi.2014.00004. https://pubmed.ncbi.nlm.nih.gov/24550825/
- Huskisson E, Maggini S, Ruf M. The influence of micronutrients on cognitive function and performance. J Int Med Res. 2007 Jan-Feb;35(1):1-19. doi: 10.1177/147323000703500101. https://pubmed.ncbi.nlm.nih.gov/17408051/
- Ozawa M, Ninomiya T, Ohara T, Hirakawa Y, Doi Y, Hata J, Uchida K, Shirota T, Kitazono T, Kiyohara Y. Self-reported dietary intake of potassium, calcium, and magnesium and risk of dementia in the Japanese: the Hisayama Study. J Am Geriatr Soc. 2012 Aug;60(8):1515-20. doi: 10.1111/j.1532-5415.2012.04061.x. https://pubmed.ncbi.nlm.nih.gov/22860881/
- Richard EL, Laughlin GA, Kritz-Silverstein D, Reas ET, Barrett-Connor E, McEvoy LK. Dietary Patterns and Cognitive Function among Older Community-Dwelling Adults. Nutrients. 2018 Aug 14;10(8):1088. doi: 10.3390/nu10081088. https://pubmed.ncbi.nlm.nih.gov/30110945/
- Zhang Y, Xun P, Wang R, Mao L, He K. Can Magnesium Enhance Exercise Performance? Nutrients. 2017 Aug 28;9(9):946. doi: 10.3390/nu9090946. https://pubmed.ncbi.nlm.nih.gov/28846654/
- Rosanoff A, Weaver CM, Rude RK. Suboptimal magnesium status in the United States: are the health consequences underestimated? Nutr Rev. 2012 Mar;70(3):153-64. doi: 10.1111/j.1753-4887.2011.00465.x. https://pubmed.ncbi.nlm.nih.gov/22364157/
- Hardwick LL, Jones MR, Brautbar N, Lee DB. Magnesium absorption: mechanisms and the influence of vitamin D, calcium and phosphate. J Nutr. 1991 Jan;121(1):13-23. doi: 10.1093/jn/121.1.13. https://pubmed.ncbi.nlm.nih.gov/1992050/
- van der Schaft J, Koek HL, Dijkstra E, Verhaar HJ, van der Schouw YT, Emmelot-Vonk MH. The association between vitamin D and cognition: a systematic review. Ageing Res Rev. 2013 Sep;12(4):1013-23. doi: 10.1016/j.arr.2013.05.004. https://pubmed.ncbi.nlm.nih.gov/23727408/
- Hoyer WJ, Stawski RS, Wasylyshyn C, Verhaeghen P. Adult age and digit symbol substitution performance: a meta-analysis. Psychol Aging. 2004 Mar;19(1):211-4. doi: 10.1037/0882-7974.19.1.211. https://pubmed.ncbi.nlm.nih.gov/15065945/
- Chen SP, Bhattacharya J, Pershing S. Association of Vision Loss With Cognition in Older Adults. JAMA Ophthalmol. 2017 Sep 1;135(9):963-970. doi: 10.1001/jamaophthalmol.2017.2838. https://pubmed.ncbi.nlm.nih.gov/28817745/
- Slutsky I, Abumaria N, Wu LJ, Huang C, Zhang L, Li B, Zhao X, Govindarajan A, Zhao MG, Zhuo M, Tonegawa S, Liu G. Enhancement of learning and memory by elevating brain magnesium. Neuron. 2010 Jan 28;65(2):165-77. doi: 10.1016/j.neuron.2009.12.026. https://pubmed.ncbi.nlm.nih.gov/20152124/
- Singh M. Essential fatty acids, DHA and human brain. Indian J Pediatr. 2005 Mar;72(3):239-42. https://pubmed.ncbi.nlm.nih.gov/15812120/
- Weiser MJ, Butt CM, Mohajeri MH. Docosahexaenoic Acid and Cognition throughout the Lifespan. Nutrients. 2016 Feb 17;8(2):99. doi: 10.3390/nu8020099. https://pubmed.ncbi.nlm.nih.gov/26901223/
- Craft NE, Haitema TB, Garnett KM, Fitch KA, Dorey CK. Carotenoid, tocopherol, and retinol concentrations in elderly human brain. J Nutr Health Aging. 2004;8(3):156-62. https://pubmed.ncbi.nlm.nih.gov/15129301/
- Johnson EJ, Vishwanathan R, Johnson MA, Hausman DB, Davey A, Scott TM, Green RC, Miller LS, Gearing M, Woodard J, Nelson PT, Chung HY, Schalch W, Wittwer J, Poon LW. Relationship between Serum and Brain Carotenoids, α-Tocopherol, and Retinol Concentrations and Cognitive Performance in the Oldest Old from the Georgia Centenarian Study. J Aging Res. 2013;2013:951786. doi: 10.1155/2013/951786. https://pubmed.ncbi.nlm.nih.gov/23840953/
- Lieblein-Boff JC, Johnson EJ, Kennedy AD, Lai CS, Kuchan MJ. Exploratory Metabolomic Analyses Reveal Compounds Correlated with Lutein Concentration in Frontal Cortex, Hippocampus, and Occipital Cortex of Human Infant Brain. PLoS One. 2015 Aug 28;10(8):e0136904. doi: 10.1371/journal.pone.0136904. https://pubmed.ncbi.nlm.nih.gov/26317757/
- Bowman GL, Silbert LC, Howieson D, Dodge HH, Traber MG, Frei B, Kaye JA, Shannon J, Quinn JF. Nutrient biomarker patterns, cognitive function, and MRI measures of brain aging. Neurology. 2012 Jan 24;78(4):241-9. doi: 10.1212/WNL.0b013e3182436598. https://pubmed.ncbi.nlm.nih.gov/22205763/
- Kryscio RJ, Abner EL, Caban-Holt A, Lovell M, Goodman P, Darke AK, Yee M, Crowley J, Schmitt FA. Association of Antioxidant Supplement Use and Dementia in the Prevention of Alzheimer's Disease by Vitamin E and Selenium Trial (PREADViSE). JAMA Neurol. 2017 May 1;74(5):567-573. doi: 10.1001/jamaneurol.2016.5778. https://pubmed.ncbi.nlm.nih.gov/28319243/
- Nasreddine ZS, Phillips NA, Bédirian V, Charbonneau S, Whitehead V, Collin I, Cummings JL, Chertkow H. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am Geriatr Soc. 2005 Apr;53(4):695-9. doi: 10.1111/j.1532-5415.2005.53221.x. https://pubmed.ncbi.nlm.nih.gov/15817019/

PEER REVIEWED
INTEGRATORI E CERVELLO





