Cosmetic regulation
Francesco Gregorini
Responsabile Area Sicurezza Prodotto
Cepra Srl | Italia


Bio...
Francesco Gregorini:
Responsabile Area Sicurezza Prodotto
Responsabile Gestione Clienti
- Responsabile Settore Prodotto presso CEPRA srl - consulting & testing.
- Vice Presidente SICC - Società Italiana di Chimica e scienze Cosmetologiche
- Consulente abilitato per la sicurezza dei trasporti di merci pericoloso (DGSA)
- Consulente abilitato REMADE IN ITALY
- Membro Ordine dei Chimici Interprovinciale dell'Emilia Romagna
- Membro EurChem - Chimico Europeo
Antonella Ceretti:
Perito chimico industriale, consulente per la sicurezza sul lavoro, specializzata in rischio chimico e monitoraggi.
Giulia Frabboni:
Farmacista e diplomata in Scienze e Tecnologie cosmetiche, specializzata nella valutazione di sicurezza dei prodotti cosmetici
Francesca Romagnoli:
Laureata in scienze farmaceutiche applicate, specializzata nella redazione di schede di sicurezza e in classificazione ed etichettatura dei prodotti chimici
I prossimi mesi saranno sicuramente scenario di notevoli cambiamenti all’interno del panorama tecnico-regolatorio relativo ai prodotti cosmetici.
Sono infatti molteplici gli aggiornamenti normativi che entreranno in vigore, portando con sé numerosi impatti sugli allegati del Regolamento 1223/2009 e, di conseguenza, nuove sfide di natura formulativa e regolatoria.
Omnibus Act VI
Tra gli aggiornamenti più incisivi ricordiamo sicuramente il nuovo Regolamento Omnibus Act, che scaturisce dell’entrata in vigore, il prossimo 1 dicembre 2023, del Reg. Delegato (UE) 2022/692 (o XVIII ATP) (1).
La nuova classificazione di sostanze ad interesse cosmetico determinerà dunque l’inserimento di alcuni ingredienti all’interno degli Allegati del Regolamento 1223/2009.
Di seguito un elenco di alcune sostanze di ampio impiego cosmetico che, sulla base della nuova classificazione come sostanze cancerogene, mutagene o tossiche per la riproduzione (CMR), saranno inserite in Allegato II e saranno pertanto vietate nei prodotti cosmetici:
- Benzophenone (CAS 119-61-9) – classificato Carcinogenic 1B
- Teophylline (CAS 58-55-9) – classificato Reprotoxic 1B
- Melamine (CAS 108-78-1) – classificato Carcinogenic 2
- Azadirachta Extracts (CAS 84696-25-3) – classificato Carcinogenic 2
- Trimethylolpropane Triacrylate (CAS 15625-89-5) – classificato Carcinogenic 2
- Pentetic Acid (CAS 67-43-6) – classificato Reprotoxic 1B
- Pentasodium pentetate (CAS 140-01-2) – classificato Reprotoxic 1B
L’applicazione della normativa è prevista per il 1 dicembre 2023.
Nuova etichettatura allergeni
Come è noto, è stato definitivamente approvato il Regolamento di Adeguamento tecnico che comporterà l’aggiunta di 56 nuovi allergeni nell’Allegato III del Regolamento 1223/2009.
Le modalità saranno le stesse previste per i 26 allergeni già elencati, dovranno essere quindi dichiarati in etichetta quando la loro concentrazione nel cosmetico supera:
- lo 0,001% nei prodotti leave-on
- lo 0,01% nei prodotti rinse off.
Sono state confermate anche le tempistiche di adeguamento, pari a 3 anni per l’immissione sul mercato e a 5 anni per il ritiro dal mercato di prodotti non conformi.
Rimane da chiarire come affrontare il caso in cui l’allergene sia presente nel cosmetico sia come sostanza che come impurezza.
Bozza di Regolamento Omnibus Act nano
È stata recentemente pubblicata la bozza di Omnibus Act relativa ad alcune sostanze nano, per le quali SCCS nei suoi pareri ha individuato una base di preoccupazione oppure una mancanza di dati sufficienti per raggiungere una conclusione adeguata (2).
Al fine quindi di garantire un elevato livello di protezione della salute umana è stato ritenuto necessario applicare uniformemente nel mercato interno il divieto di utilizzare i seguenti nanomateriali:Styrene/Acrylatescopolymer, SodiumStyrene/Acrylatescopolymer, Copper, ColloidalCopper, Hydroxyapatite, Gold, ColloidalGold, Gold ThioethylaminoHyaluronicAcid, Acetylheptapeptide-9 Colloidalgold, Platinum, ColloidalPlatinum, Acetyltetrapeptide-17 ColloidalPlatinum e ColloidalSilver.
Bozza Omnibus Act su Vitamina A, alfa-arbutina, arbutina e alcune sostanze con potenziali proprietà di interferenza endocrina nei prodotti cosmetici
È stata recentemente pubblicata una bozza di Regolamento Omnibus Act relativa ad alcune sostanze per cui SCCS ha individuato alcuni potenziali rischi collegati all’impiego nei prodotti cosmetici.
I possibili provvedimenti riguardano divieti e restrizioni che impatterebbero sugli Allegati II, III, V e VI del Regolamento cosmetici, come riassunto nella tabella sottostante.
Omnibus Act, allergeni e MoCRA:
le novità in ambito tecnico-regolatorio
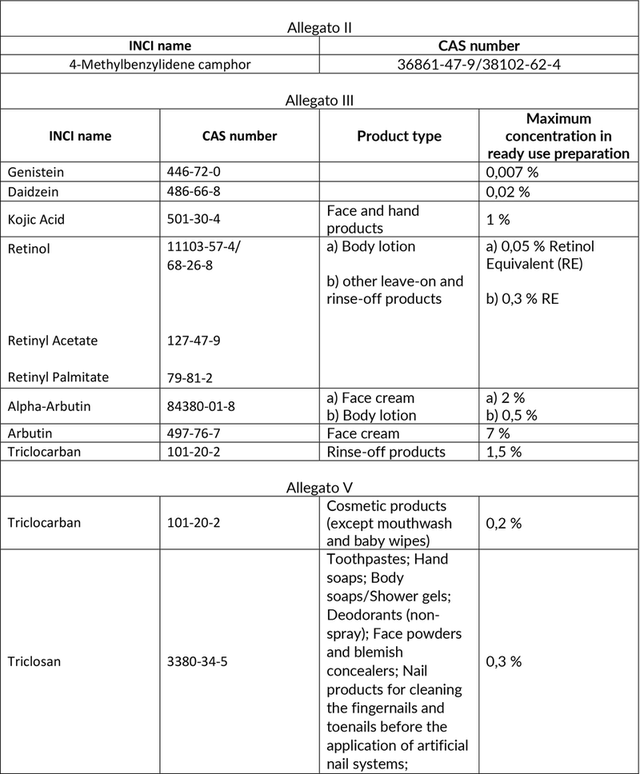
Figura 1. Illustrazione degli aspetti legati alla sicurezza e alla sostenibilità della sostanza chimica o del materiale interessati dalla valutazione della sicurezza e della sostenibilità. Il puntino rosso rappresenta la sostanza chimica o al materiale oggetto di valutazione, mentre i puntini gialli e grigi rappresentano tutte le altre sostanze emesse durante il suo ciclo di vita.
Modernization of Cosmetics Regulation Act
Tra le novità più impattanti che riguardano il mercato extra-EU vi è sicuramente il MoCRA (Modernization of Cosmetics Regulation Act) che andrà a modificare il Federal Food, Drug, and Cosmetic Act (FD&C Act) Chapter VI: Cosmetics (3).
Le principali modifiche riguarderanno, tra le altre
- La Persona Responsabile
Dovrà essere designata una Persona Responsabile per ogni prodotto cosmetico, che potrà essere il produttore, il packager o il distributore. Il suo nome e l’indirizzo dovranno comparire sull’etichetta e sarà responsabile della conformità del prodotto sul mercato, della cosmetovigilanza e di tutti gli aspetti regolatori relativi al cosmetico.
- Registrazione aziende e prodotti
È previsto che ogni sito / stabilimento che produce, lavora o importa prodotti cosmetici distribuiti negli Stati Uniti dovrà registrarsi e mantenere una registrazione valida presso la FDA.
- GMP
La produzione di cosmetici dovrà avvenire in stabilimenti che applicano le GMP
- Ingredienti cosmetici e sui prodotti finiti
Sarà presto pubblicato un metodo ufficiale per rilevare la presenza di amianto nei prodotti contenenti talco.
Anche la documentazione sulla sicurezza è un punto importante del Modernization of Cosmetic Regulation Act. Infatti, la Persona Responsabile deve garantire e conservare le registrazioni che attestano l’esistenza di un’adeguata giustificazione della sicurezza.
- Etichettatura dei cosmetici
Oltre ai requisiti esistenti, ogni prodotto cosmetico dev’essere etichettato con alcune informazioni aggiuntive obbligatorie, come le informazioni di contatto e del sito internet attraverso cui la Persona Responsabile possa ricevere le segnalazioni di reazioni avverse e l’introduzione della dichiarazione degli allergeni in etichetta.




