SARCOPENIA DA INVECCHIAMENTO:
RUOLO DELL’INTEGRAZIONE NUTRACEUTICA NEI PROTOCOLLI DI PREVENZIONE E TRATTAMENTO

Il termine sarcopenia fu introdotto per la prima volta nel 1997 dal Professor Irwin H. Rosenberg, in un articolo pubblicato sulla rivista The Journal of Nutrition (1), per descrivere una condizione età-correlata che porta a declino della struttura e della funzione muscolare, con importanti e talora gravi ripercussioni sul piano della salute, della mobilità e dell’autonomia. Se non adeguatamente prevenuta (o trattata), in termini sociali ed economici la sarcopenia diventa un onere per i sistemi sanitari che devono così necessariamente rispondere a crescenti costi di ospedalizzazione (2) legati alla presenza di un’ampia fascia di anziani che diventano “fragili” e maggiormente soggetti a sviluppare malattie.
COS’È LA SARCOPENIA DA INVECCHIAMENTO
La massa muscolare e la forza variano nel corso della vita: nei giovani adulti (fino a circa 30 anni di età), si raggiungono i massimi livelli di espressione, con differenze tra uomini e donne (3), mentre a partire dai 40 anni si possono già evidenziare le prime perdite di massa muscolare, che diverranno sempre più manifeste superati i 50 anni (Figura 1) (4), con riduzione di massa muscolare di circa l’1% all’anno (5), perdita del patrimonio fibrale tipo II (dimezzato intorno agli 80 anni (6)) e calo progressivo della forza (decadimento/anno tra 1,5 e 5% (7)). Fattori genetici e stile di vita (come sedentarietà, associata soprattutto ad assenza di allenamento di forza, e malnutrizione), possono accelerare l'indebolimento muscolare e la progressione verso la sarcopenia, la quale si accompagna anche ad alterazioni neuromuscolari e perdita significativa dei motoneuroni spinali (8)(9)(10). Una volta sviluppata, la sarcopenia (diagnosticabile attraverso metodiche validate di misura) compromette la salute e la qualità di vita dei soggetti: induce debolezza e fragilità, aumentando il rischio di cadute e fratture; riduce la velocità del passo, circa il 20% in meno rispetto a soggetti della stessa età e genere (2); compromette semplici attività quotidiane, come salire e scendere le scale, sollevare oggetti o alzarsi dalla sedia, aumentando il senso di fatica (11); la forza di presa manuale diminuisce di circa il 20% (2); diminuisce il dispendio energetico a riposo (12) e la sensibilità periferica all’insulina (13), favorendo l’accumulo di grasso sottocutaneo e viscerale (14); si associa, inoltre, ad un più elevato rischio di mortalità (15). Da un punto di vista molecolare, l’evoluzione della sarcopenia da invecchiamento è legata in particolare a una progressiva predominanza delle vie di segnale che controllano i fenomeni catabolici (degradazione), con un’attenuazione dei processi di sintesi proteica. Tali eventi sono disregolati da alterazioni età-correlate di processi che coinvolgono il sistema endocrino e una maggiore produzione di citochine pro-infiammatorie (16).
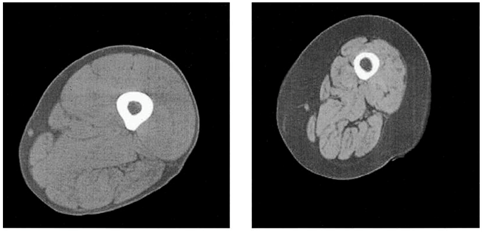
Figura 1. Confronto tra due immagini di risonanza magnetica a livello della parte centrale della coscia di un giovane adulto sano di 25 anni (a sinistra) e di un soggetto anziano sarcopenico di 75 anni (a destra). Nel soggetto anziano (a destra) si evidenza una muscolare drasticamente ridotta (grigio chiaro), un elevato aumento del grasso sottocutaneo (grigio scuro) e del grasso intramuscolare (linee grigio scuro) (4).
SVILUPPO E PROGRESSIONE DELLA SARCOPENIA: MECCANISMI COINVOLTI
Oltre all’attività fisica, in particolare attraverso la pianificazione di programmi settimanali che includano carichi di forza sul muscolo, e a un’adeguata programmazione dietetica giornaliera, importante per stabilire un corretto regime nutrizionale generale, fondamentale è predisporre una corretta somministrazione ciclica di integratori nutraceutici e alimenti a fini medici speciali, utili per intervenire là dove la sola dieta non è sufficiente. Su quest’ultimo argomento la letteratura mette a disposizioni dati e indicazioni veramente interessanti che riguardano l’utilizzo di numerose sostanze ad attività nutraceutica.
Aminoacidi essenziali (EAA) e leucina
Gli EAA rappresentano lo stimolo principale per la sintesi proteica muscolare e per il mantenimento di massa e forza muscolare in età avanzata (17). La leucina è considerata l’EAA più potente per l’attivazione delle sintesi poiché è in grado di attivare il complesso mTORC1, regolatore fondamentale di traslazione e biogenesi ribosomiale: passaggi chiave per la sintesi delle proteine (18). Dati indicano come gli anziani necessitino di una quantità di proteine maggiore rispetto ai più giovani per ottenere la stessa stimolazione di sintesi proteica muscolare, con una soglia di utilizzo di leucina più alta. Pertanto, l’introduzione di maggiori quantità giornaliere di leucina, attraverso opportuni integratori di EAA, risulta essere benefica per questi soggetti al fine di stimolare il trofismo della massa muscolare (19)(20)(21)(22). In molti studi sono stati ottenuti effetti positivi con dosaggi di leucina pari a circa 3 g/die (19)(20)(23).
Vitamina D
La perdita di massa muscolare spesso si associa a carenza di vitamina D. I recettori della vitamina D sono ampiamente espressi a livello muscolare; tuttavia, la loro presenza diminuisce con l'età, contribuendo allo sviluppo della sarcopenia (6). Grazie al legame con i suoi recettori, la vitamina D promuove alcune importanti funzioni muscolari: la capacità contrattile, regolando l'afflusso di calcio; la differenziazione dei mioblasti, fondamentale nei meccanismi di riparazione tissutale; la sensibilità all'insulina, che con l’età viene compromessa (24). Ampi studi trasversali su popolazioni anziane confermano una relazione tra livello insufficiente di vitamina D nel siero (<50 nmol/L) e scarse prestazioni fisiche (24)(25)(26)(27)(28)(29), mobilità (25)(27)(28)(29), forza muscolare (25)(26)(28)(29)(30)(31)(32)(33)(34) e maggiore disabilità(31). La maggior parte degli studi disponibili ha dimostrato che i benefici si osservano con dosi d’integrazione di vitamina D comprese tra 800 e 2000 UI/die (32).
Creatina
La creatina è una sostanza diffusa in molti distretti corporei (come cuore e cervello), ma prevalentemente (circa il 95%) viene accumulata nel muscolo scheletrico (35) sottoforma di fosfocreatina e creatina libera. Diversi studi hanno dimostrato che l'integrazione di creatina monoidrato, in aggiunta a un protocollo di allenamento di forza, può aumentare la massa muscolare e la forza negli anziani (36)(37)(38). Tali effetti sono ottenibili attraverso numerosi meccanismi: l’ottimizzazione energetica delle fibre (39); la prevenzione della degradazione proteica (38); lo stimolo sull’attivazione e la differenziazione delle cellule satelliti (40)(41); l’aumento nell’espressione di fattori miogenici di regolazione (MRF-4, Myf-5, Myo-D, e myogenin), legati all’espressione genica di proteine muscolari come la miosina, l’α-actinina, la troponina I, e la creatin chinasi (42). L’ampia quantità di studi reperibile in letteratura prova che l'integrazione di creatina può avere un potenziale beneficio sulla sarcopenia (43)(44)(45), mentre merita maggior approfondimento il ruolo di una co-integrazione di creatina con aminoacidi, benché i dati disponibili siano piuttosto promettenti (46). La maggior parte dei lavori suggerisce una dose di 3 g/die di creatina per attenuare il declino della massa e funzione muscolare (20).
β-idrossi-β-metilbutirrato (HMB)
l’HMB è un metabolita della leucina (circa 5-10% della leucina viene convertita in HMB), il quale svolge un’azione spiccatamente anticatabolica sul tessuto muscolare scheletrico, evidenziabile soprattutto in condizioni di compromissione, coinvolgendo diversi meccanismi (stimolo della sintesi proteica, controllo sull’attivazione e proliferazione delle cellule satelliti; inibizione del sistema ubiquitina-proteosoma, inibizione delle caspasi 3 e 8) e vie di segnalazione (Akt/mTOR/p70S6, MAPK/ERK e PI3K/Akt) (47)(48)(49)(50)(51). È stato dimostrato che la supplementazione orale di HMB migliora la forza muscolare sia nei pazienti sarcopenici malnutriti, sia nei pazienti con sarcopenia lieve-moderata (52), con risultati interessanti anche su pazienti ospedalizzati in fase di riabilitazione e recupero metabolico (53). L’efficacia di un’integrazione nutraceutica con HMB si raggiunge con dosaggi giornalieri compresi tra 1,5 e 3 g.
Acidi grassi omega-3 (ω-3)
Secondo vari studi, gli acidi grassi ω-3, in particolare EPA e DHA, hanno proprietà antinfiammatorie che risultano benefiche per massa, forza e funzione muscolare, prevenendo l'infiammazione cronica di basso grado legata all'età, la quale contribuisce allo sviluppo della sarcopenia (54). Tuttavia, nei pazienti con sarcopenia, l'integrazione di acidi grassi ω-3 sembra favorire l’aumento della massa muscolare e prevenire il catabolismo indipendentemente dagli effetti antinfiammatori, coinvolgendo l’attivazione di mTOR e riducendo la resistenza insulinica età-correlata (54). Sebbene quindi i meccanismi attraverso i quali gli acidi grassi ω-3 esercitano il loro effetto su massa e funzione muscolare non siano ancora del tutto chiari e siano necessari ulteriori studi (55), un numero crescente di lavori dimostra il potenziale effetto benefico dell’integrazione nutraceutica con acidi grassi ω-3 nei soggetti anziani (54), con dosaggi tipicamente compresi tra 2 e 4 g al giorno (56).
Acido alfa lipoico (ALA), coenzima Q10 (CoQ10) e resveratrolo
Tra le sostanze con effetti di natura antinfiammatoria e antiossidante, spiccano, infine, molecole come l’ALA, il CoQ10 e il resveratrolo, che associate a EAA, vitamina D e creatina, in uno studio condotto presso il Centro di Medicina dello Sport dell’Università di Pavia e pubblicato sulla rivista Journal of Nutrition, Health and Aging, dopo 12 settimane di assunzione hanno dimostrato di poter migliorare efficacemente il trofismo muscolare in soggetti di circa 70 anni di età (tabella 1) (46). L’ALA possiede, infatti, spiccate proprietà antinfiammatorie, e può dare riduzioni significative (-15%) dei livelli sierici di interleuchina-6 già dopo 4 settimane di somministrazione orale (57). Altri studi dimostrano una correlazione tra i livelli ematici di CoQ10 e l’espressione della forza muscolare (58), con effetti modulatori sull’infiammazione (59) e lo stress ossidativo (60) in soggetti anziani dopo 4 settimane di trattamento. Il resveratrolo, polifenolo di origine vegetale, è forse il più promettente tra queste sostanze, dimostrando effetti a diversi livelli: antiossidante (61); sul trofismo delle fibre muscolari scheletriche (tipo IIA e IIB), con aumento del numero dei mionuclei (62), stimolando la via di segnalazione Akt-mTORC1-FoxO1 e inibendo l’attività della ubiquitina ligasi (63); sulla capacità mitocondriale, mediante attivazione della via AMPK-SIRT1-PGC1α (64)(65)(66).
STRATEGIE DI PREVENZIONE E TRATTAMENTO: DALL’ATTIVITÀ FISICA ALL’INTEGRAZIONE NUTRACEUTICA
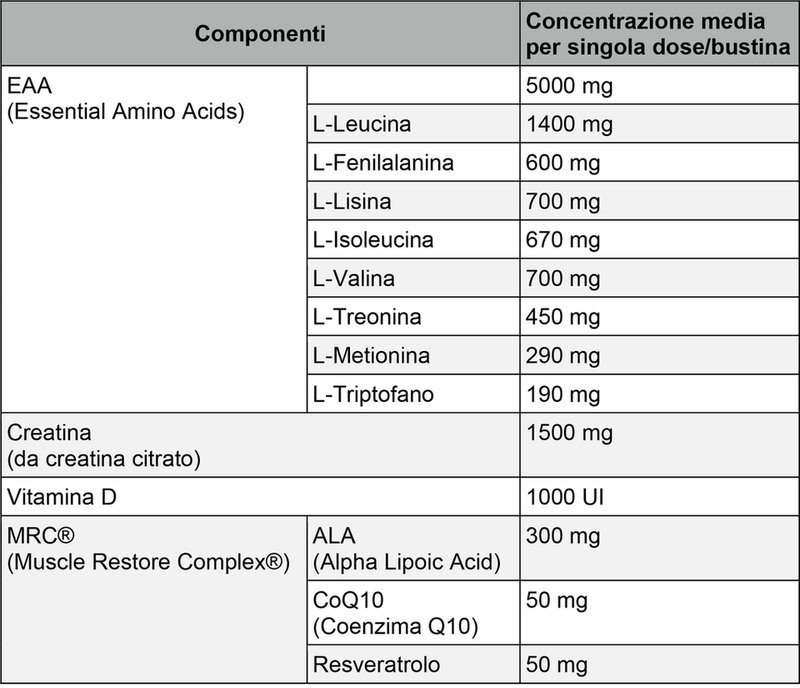
Tabella 1. Formulazione del supplemento multi-ingrediente a base di EAA (46).
Nota: nello studio (46) sono state utilizzate due buste al giorno.
Riferimenti bibliografici
(1) I. H. Rosenberg: «Sarcopenia: origins and clinical relevance», J. Nutr., vol. 127, fasc. 5 Suppl, pp. 990S-991S, mag. 1997, doi: 10.1093/jn/127.5.990S.
(2) A. Clegg, J. Young, S. Iliffe, et al.: «Frailty in elderly people», Lancet Lond. Engl., vol. 381, fasc. 9868, pp. 752–762, mar. 2013, doi: 10.1016/S0140-6736(12)62167-9.
(3) R. M. Dodds, et al.: «Grip strength across the life course: normative data from twelve British studies», PloS One, vol. 9, fasc. 12, p. e113637, 2014, doi: 10.1371/journal.pone.0113637.
(4) R. Roubenoff: «Sarcopenia: Effects on Body Composition and Function», J. Gerontol. A. Biol. Sci. Med. Sci., vol. 58, pp. 1012–7, dic. 2003, doi: 10.1093/gerona/58.11.M1012.
(5) S. Von Haehling, J. E. Morley, S. D. Anker: «An overview of sarcopenia: facts and numbers on prevalence and clinical impact», fasc. 1, pp. 129–133, 2010.
(6) J. A. Faulkner, L. M. Larkin, D. R. Claflin, et al.: «Age-related changes in the structure and function of skeletal muscles», Clin. Exp. Pharmacol. Physiol., vol. 34, fasc. 11, pp. 1091–1096, nov. 2007, doi: 10.1111/j.1440-1681.2007.04752.x.
(7) K. Keller e M. Engelhardt: «Strength and muscle mass loss with aging process. Age and strength loss», Muscles Ligaments Tendons J., vol. 3, fasc. 4, pp. 346–350, ott. 2013.
(8) M. Kara, B. Kaymak, W. Frontera, et al.: «Diagnosing sarcopenia: functional perspectives and a new algorithm from isarcoprm», J. Rehabil. Med., vol. 53, fasc. 6, p. 2806, giu. 2021, doi: 10.2340/16501977-2851.
(9) A. Vasilaki, A. Richardson, H. Van Remmen, et al.: «Role of nerve-muscle interactions and reactive oxygen species in regulation of muscle proteostasis with ageing», J. Physiol., vol. 595, fasc. 20, pp. 6409–6415, ott. 2017, doi: 10.1113/JP274336.
(10) O. Delbono: «Neural control of aging skeletal muscle», Aging Cell, vol. 2, fasc. 1, pp. 21–29, feb. 2003, doi: 10.1046/j.1474-9728.2003.00011.x.
(11) E. J. Bassey, M. A. Fiatarone, E. F. O’Neill, et al.: «Leg extensor power and functional performance in very old men and women», Clin. Sci. Lond. Engl. 1979, vol. 82, fasc. 3, pp. 321–327, mar. 1992, doi: 10.1042/cs0820321.
(12) R. Roubenoff e V. A. Hughes: «Sarcopenia: current concepts», J. Gerontol. A. Biol. Sci. Med. Sci., vol. 55, fasc. 12, pp. M716-724, dic. 2000, doi: 10.1093/gerona/55.12.m716.
(13) Manno R.: «Strength ability in aged people», Ital J Sports Sci, vol. 11, pp. 16–22, 2004.
(14) R. J. Zacker: «Health-related implications and management of sarcopenia», JAAPA Off. J. Am. Acad. Physician Assist., vol. 19, fasc. 10, pp. 24–29, ott. 2006, doi: 10.1097/01720610-200610000-00008.
(15) E. J. Metter, L. A. Talbot, M. Schrager, et al.: «Skeletal muscle strength as a predictor of all-cause mortality in healthy men», J. Gerontol. A. Biol. Sci. Med. Sci., vol. 57, fasc. 10, pp. B359-365, ott. 2002, doi: 10.1093/gerona/57.10.b359.
(16) Z. Xia, J. Cholewa, Y. Zhao, et al.: «Targeting Inflammation and Downstream Protein Metabolism in Sarcopenia: A Brief Up-Dated Description of Concurrent Exercise and Leucine-Based Multimodal Intervention», Front. Physiol., vol. 8, p. 434, giu. 2017, doi: 10.3389/fphys.2017.00434.
(17) A. J. Cruz-Jentoft, S. Romero-Yuste, E. Chamizo Carmona, et al:. «Sarcopenia, immune-mediated rheumatic diseases, and nutritional interventions», Aging Clin. Exp. Res., vol. 33, fasc. 11, pp. 2929–2939, 2021, doi: 10.1007/s40520-021-01800-7.
(18) G. D’Antona: Molecular Basis of Nutrition and Aging - MTOR, Nutrition and Aging, vol. Part 2: Molecular and cellular targets. Malavolta M, Mocchegiani E, 2016.
(19) M. Rondanelli, M. Faliva, F. Monteferrario, et al.: «Novel insights on nutrient management of sarcopenia in elderly», BioMed Res. Int., vol. 2015, p. 524948, 2015, doi: 10.1155/2015/524948.
(20) S. M. Phillips: «Nutritional supplements in support of resistance exercise to counter age-related sarcopenia», Adv. Nutr. Bethesda Md, vol. 6, fasc. 4, pp. 452–460, lug. 2015, doi: 10.3945/an.115.008367.
(21) T. Ispoglou, H. White, T. Preston, et al.: «Double-blind, placebo-controlled pilot trial of L-Leucine-enriched amino-acid mixtures on body composition and physical performance in men and women aged 65-75 years», Eur. J. Clin. Nutr., vol. 70, fasc. 2, pp. 182–188, feb. 2016, doi: 10.1038/ejcn.2015.91.
(22) B. Komar, L. Schwingshackl, G. Hoffmann: «Effects of leucine-rich protein supplements on anthropometric parameter and muscle strength in the elderly: a systematic review and meta-analysis», J. Nutr. Health Aging, vol. 19, fasc. 4, pp. 437–446, apr. 2015, doi: 10.1007/s12603-014-0559-4.
(23) M. C. Devries, C. McGlory, D. R. Bolster, et al.: «Leucine, Not Total Protein, Content of a Supplement Is the Primary Determinant of Muscle Protein Anabolic Responses in Healthy Older Women», J. Nutr., vol. 148, fasc. 7, pp. 1088–1095, lug. 2018, doi: 10.1093/jn/nxy091.
(24) A. J. Dirks-Naylor, S. Lennon-Edwards: «The effects of vitamin D on skeletal muscle function and cellular signaling», J. Steroid Biochem. Mol. Biol., vol. 125, fasc. 3–5, pp. 159–168, lug. 2011, doi: 10.1016/j.jsbmb.2011.03.003.
(25) D. K. Houston, J. A. Tooze, C. C. Davis, et al.: «Serum 25-hydroxyvitamin D and physical function in older adults: the Cardiovascular Health Study All Stars», J. Am. Geriatr. Soc., vol. 59, fasc. 10, pp. 1793–1801, ott. 2011, doi: 10.1111/j.1532-5415.2011.03601.x.
(26) D. K. Houston, M. Cesari, L. Ferrucci, et al.: «Association between vitamin D status and physical performance: the InCHIANTI study», J. Gerontol. A. Biol. Sci. Med. Sci., vol. 62, fasc. 4, pp. 440–446, apr. 2007, doi: 10.1093/gerona/62.4.440.
(27) H. A. Bischoff-Ferrari, T. Dietrich, E. J. Orav, et al.: «Higher 25-hydroxyvitamin D concentrations are associated with better lower-extremity function in both active and inactive persons aged > or =60 y», Am. J. Clin. Nutr., vol. 80, fasc. 3, pp. 752–758, set. 2004, doi: 10.1093/ajcn/80.3.752.
(28) D. K. Houston, J. A. Tooze, R. H. Neiberg, et al.: «25-hydroxyvitamin D status and change in physical performance and strength in older adults: the Health, Aging, and Body Composition Study», Am. J. Epidemiol., vol. 176, fasc. 11, pp. 1025–1034, dic. 2012, doi: 10.1093/aje/kws147.
(29) E. D. Toffanello, E. Perissinotto, G. Sergi, et al.: «Vitamin D and physical performance in elderly subjects: the Pro.V.A study», PloS One, vol. 7, fasc. 4, p. e34950, 2012, doi: 10.1371/journal.pone.0034950.
(30) M. Mowé, E. Haug, T. Bøhmer: «Low serum calcidiol concentration in older adults with reduced muscular function», J. Am. Geriatr. Soc., vol. 47, fasc. 2, pp. 220–226, feb. 1999, doi: 10.1111/j.1532-5415.1999.tb04581.x.
(31) M. Zamboni, E. Zoico, P. Tosoni, et al.: «Relation between vitamin D, physical performance, and disability in elderly persons», J. Gerontol. A. Biol. Sci. Med. Sci., vol. 57, fasc. 1, pp. M7-11, gen. 2002, doi: 10.1093/gerona/57.1.m7.
(32) T.-T. L. Dam, D. von Mühlen, E. L. Barrett-Connor: «Sex-specific association of serum vitamin D levels with physical function in older adults», Osteoporos. Int. J. Establ. Result Coop. Eur. Found. Osteoporos. Natl. Osteoporos. Found. USA, vol. 20, fasc. 5, pp. 751–760, mag. 2009, doi: 10.1007/s00198-008-0749-1.
(33) I. S. Wicherts, N. M. Van Schoor, A. J. P. Boeke, et al.: «Vitamin D status predicts physical performance and its decline in older persons», J. Clin. Endocrinol. Metab., vol. 92, fasc. 6, pp. 2058–2065, giu. 2007, doi: 10.1210/jc.2006-1525.
(34) M. Visser, D. J. H. Deeg, P. Lips: «Low vitamin D and high parathyroid hormone levels as determinants of loss of muscle strength and muscle mass (sarcopenia): the Longitudinal Aging Study Amsterdam», J. Clin. Endocrinol. Metab., vol. 88, fasc. 12, pp. 5766–5772, dic. 2003, doi: 10.1210/jc.2003-030604.
(35) J. B. Walker: «Creatine: biosynthesis, regulation, and function», Adv. Enzymol. Relat. Areas Mol. Biol., vol. 50, pp. 177–242, 1979, doi: 10.1002/9780470122952.ch4.
(36) D. G. Candow, S. C. Forbes, B. Kirk, et al.: «Current Evidence and Possible Future Applications of Creatine Supplementation for Older Adults», Nutrients, vol. 13, fasc. 3, p. 745, feb. 2021, doi: 10.3390/nu13030745.
(37) S. C. Forbes, D. G. Candow, S. M. Ostojic, et al.: «Meta-Analysis Examining the Importance of Creatine Ingestion Strategies on Lean Tissue Mass and Strength in Older Adults», Nutrients, vol. 13, fasc. 6, p. 1912, giu. 2021, doi: 10.3390/nu13061912.
(38) R. B. Kreider, D. S. Kalman, J. Antonio, et al.: «International Society of Sports Nutrition position stand: safety and efficacy of creatine supplementation in exercise, sport, and medicine», J. Int. Soc. Sports Nutr., vol. 14, p. 18, 2017, doi: 10.1186/s12970-017-0173-z.
(39) D. A. Bonilla, R. B. Kreider, J. R. Stout, et al.: «Metabolic Basis of Creatine in Health and Disease: A Bioinformatics-Assisted Review», Nutrients, vol. 13, fasc. 4, p. 1238, apr. 2021, doi: 10.3390/nu13041238.
(40) J. Kim, J. Lee, S. Kim, et al.: «Role of creatine supplementation in exercise-induced muscle damage: A mini review», J. Exerc. Rehabil., vol. 11, fasc. 5, pp. 244–250, ott. 2015, doi: 10.12965/jer.150237.
(41) S. Olsen, P. Aagaard, F. Kadi, et al.: «Creatine supplementation augments the increase in satellite cell and myonuclei number in human skeletal muscle induced by strength training», J. Physiol., vol. 573, fasc. Pt 2, pp. 525–534, giu. 2006, doi: 10.1113/jphysiol.2006.107359.
(42) D. S. Willoughby, J. M. Rosene: «Effects of oral creatine and resistance training on myogenic regulatory factor expression», Med Sci Sports Exerc, vol. 35, pp. 923–9., 2003.
(43) P.-O. Hasselgren: «β-Hydroxy-β-methylbutyrate (HMB) and prevention of muscle wasting», Metabolism., vol. 63, fasc. 1, pp. 5–8, gen. 2014, doi: 10.1016/j.metabol.2013.09.015.
(44) D. G. Candow, S. C. Forbes, P. D. Chilibeck, et al.: «Effectiveness of Creatine Supplementation on Aging Muscle and Bone: Focus on Falls Prevention and Inflammation», J. Clin. Med., vol. 8, fasc. 4, p. 488, apr. 2019, doi: 10.3390/jcm8040488.
(45) E. Gielen, A. Delaere, S. De Breucker, et al.: «Nutritional interventions to improve muscle mass, muscle strength, and physical performance in older people: an umbrella review of systematic reviews and meta-analyses», Nutr. Rev., vol. 79, fasc. 2, pp. 121–147, gen. 2021, doi: 10.1093/nutrit/nuaa011.
(46) M. Negro, S. Perna, D. Spadaccini, et al.: «Effects of 12 Weeks of Essential Amino Acids (EAA)-Based Multi-Ingredient Nutritional Supplementation on Muscle Mass, Muscle Strength, Muscle Power and Fatigue in Healthy Elderly Subjects: A Randomized Controlled Double-Blind Study.», J Nutr Health Aging, vol. 23, fasc. 5, pp. 414–424, 2019, doi: 10.1007/s12603-019-1163-4.
(47) M. Holeček: «Beta-hydroxy-beta-methylbutyrate supplementation and skeletal muscle in healthy and muscle-wasting conditions», J. Cachexia Sarcopenia Muscle, vol. 8, fasc. 4, pp. 529–541, ago. 2017, doi: 10.1002/jcsm.12208.
(48) A. P. Rossi, A. D'Introno, S. Rubele, et al.: «The Potential of β-Hydroxy-β-Methylbutyrate as a New Strategy for the Management of Sarcopenia and Sarcopenic Obesity», Drugs Aging, vol. 34, fasc. 11, pp. 833–840, nov. 2017, doi: 10.1007/s40266-017-0496-0.
(49) D. E. Bear, A. J. Cruz-Jentoft, J. R. Stout: «β-hydroxy-β-methylbutyrate supplementation in older persons - an update», Curr. Opin. Clin. Nutr. Metab. Care, vol. 24, fasc. 1, pp. 48–52, gen. 2021, doi: 10.1097/MCO.0000000000000713.
(50) Y. Zhong, L. Zeng, J. Deng, et al.: «β-hydroxy-β-methylbutyrate (HMB) improves mitochondrial function in myocytes through pathways involving PPARβ/δ and CDK4», Nutr. Burbank Los Angel. Cty. Calif, vol. 60, pp. 217–226, apr. 2019, doi: 10.1016/j.nut.2018.09.032.
(51) R. Manjarrez-Montes-de-Oca, M. Torres-Vaca, J. González-Gallego, et al.: «β-hydroxy-β-methylbutyrate as a dietary supplement (II): cell and molecular mechanism of action», Nutr. Hosp., vol. 31, fasc. 2, pp. 597–605, nov. 2014, doi: 10.3305/nh.2015.31.2.8437.
(52) J. T. Cramer, A. J. Cruz-Jentoft, F. Landi, et al.: «Impacts of High-Protein Oral Nutritional Supplements Among Malnourished Men and Women with Sarcopenia: A Multicenter, Randomized, Double-Blinded, Controlled Trial», J. Am. Med. Dir. Assoc., vol. 17, fasc. 11, pp. 1044–1055, nov. 2016, doi: 10.1016/j.jamda.2016.08.009.
(53) A. Sanz-Paris, M. Camprubi-Robles, J. M. Lopez-Pedrosa, et al.: «Role of Oral Nutritional Supplements Enriched with β-Hydroxy-β-Methylbutyrate in Maintaining Muscle Function and Improving Clinical Outcomes in Various Clinical Settings», J. Nutr. Health Aging, vol. 22, fasc. 6, pp. 664–675, 2018, doi: 10.1007/s12603-018-0995-7.
(54) J. Dupont, L. Dedeyne, S. Dalle, et al.: «The role of omega-3 in the prevention and treatment of sarcopenia», Aging Clin. Exp. Res., vol. 31, fasc. 6, giu. 2019, doi: 10.1007/s40520-019-01146-1.
(55) A. Buoite Stella, G. Gortan Cappellari, R. Barazzoni, et al.: «Update on the Impact of Omega 3 Fatty Acids on Inflammation, Insulin Resistance and Sarcopenia: A Review», Int. J. Mol. Sci., vol. 19, fasc. 1, p. 218, gen. 2018, doi: 10.3390/ijms19010218.
(56) A. J. Cruz-Jentoft, B. Dawson Hughes, D. Scott, et al.: «NUTRITIONAL Strategies for Maintaining Muscle MASS AND STRENGTH from Middle Age to Later Life: A NARRATIVE REVIEW.», Maturitas, vol. Feb, fasc. 132, pp. 57-64., 2020, doi: 10.1016/j.maturitas.2019.11.007.
(57) S. Sola, M. Q. S. Mir, F. A. Cheema, et al.: «Irbesartan and lipoic acid improve endothelial function and reduce markers of inflammation in the metabolic syndrome: results of the Irbesartan and Lipoic Acid in Endothelial Dysfunction (ISLAND) study», Circulation, vol. 111, fasc. 3, pp. 343–348, gen. 2005, doi: 10.1161/01.CIR.0000153272.48711.B9.
(58) A. Fischer, S. Onur, P. Niklowitz, et al.: «Coenzyme Q10 Status as a Determinant of Muscular Strength in Two Independent Cohorts», PloS One, vol. 11, fasc. 12, p. e0167124, 2016, doi: 10.1371/journal.pone.0167124.
(59) L. González-Guardia, E. M. Yubero-Serrano, J. Delgado-Lista, et al.: «Effects of the Mediterranean diet supplemented with coenzyme q10 on metabolomic profiles in elderly men and women», J. Gerontol. A. Biol. Sci. Med. Sci., vol. 70, fasc. 1, pp. 78–84, gen. 2015, doi: 10.1093/gerona/glu098.
(60) E. M. Yubero-Serrano, L. Gonzalez-Guardia, O. Rangel-Zuñiga, et al.: «Mediterranean diet supplemented with coenzyme Q10 modifies the expression of proinflammatory and endoplasmic reticulum stress-related genes in elderly men and women», J. Gerontol. A. Biol. Sci. Med. Sci., vol. 67, fasc. 1, pp. 3–10, gen. 2012, doi: 10.1093/gerona/glr167.
(61) J. R. Jackson, M. J. Ryan, S. E. Always: «Long-term supplementation with resveratrol alleviates oxidative stress but does not attenuate sarcopenia in aged mice», J. Gerontol. A. Biol. Sci. Med. Sci., vol. 66, fasc. 7, pp. 751–764, lug. 2011, doi: 10.1093/gerona/glr047.
(62) B. T. Bennett, J. S. Mohamed, S. E. Always: «Effects of resveratrol on the recovery of muscle mass following disuse in the plantaris muscle of aged rats», PloS One, vol. 8, fasc. 12, p. e83518, 2013, doi: 10.1371/journal.pone.0083518.
(63) D.-T. Wang, Y. Yin, Y. Jun-Yang, et al.: «Resveratrol prevents TNF-α-induced muscle atrophy via regulation of Akt/mTOR/FoxO1 signaling in C2C12 myotubes», Int. Immunopharmacol., vol. 19, fasc. 2, pp. 206–213, apr. 2014, doi: 10.1016/j.intimp.2014.02.002.
(64) J. A. Baur, K. J. Pearson, N. L. Price, et al.: «Resveratrol improves health and survival of mice on a high-calorie diet», Nature, vol. 444, fasc. 7117, pp. 337–342, nov. 2006, doi: 10.1038/nature05354.
(65) M. Lagouge, C. Argmann, Z. Gerhart-Hines, et al.: «Resveratrol improves mitochondrial function and protects against metabolic disease by activating SIRT1 and PGC-1alpha», Cell, vol. 127, fasc. 6, pp. 1109–1122, dic. 2006, doi: 10.1016/j.cell.2006.11.013.
(66) S. Timmers, E. Konings, L. Bilet, et al.: «Calorie restriction-like effects of 30 days of resveratrol supplementation on energy metabolism and metabolic profile in obese humans», Cell Metab., vol. 14, fasc. 5, pp. 612–622, nov. 2011, doi: 10.1016/j.cmet.2011.10.002.
MASSIMO NEGRO1
DONATELLA BARILLARO1
GIUSEPPE D’ANTONA1, 2
1. CRIAMS - Centro di Medicina dello Sport - Voghera, Università di Pavia | Italia
2. Dipartimento di Sanità Pubblica, Medicina Sperimentale e Forense dell’Università di Pavia | Italia



Bio...

Massimo Negro, PhD
Dietista specializzato in Nutrizione dello Sport, Laureato in Scienze Motorie e Dottore di Ricerca in Scienze Biomediche (Fisiologia Muscolare).
Collabora con il CRIAMS-Centro di Medicina dello Sport dell’Università di Pavia, dove svolge attività di ricerca nel campo delle supplementazioni nutrizionali, a livello clinico e sportivo. Autore di lavori scientifici pubblicati su riviste internazionali peer reviewed, da oltre 20 anni è docente di Nutrizione dello Sport in corsi universitari e scuole di formazione post-laurea.

Donatella Barillaro, MSc
Biologa nutrizionista, Master in Alimentazione ed Educazione alla Salute e Master in Scienze e Tecnologie Cosmetiche. Ha prestato servizio come biologa ricercatrice nella sanità privata e docente di scienze degli alimenti nella scuola pubblica. Attualmente è tirocinante presso il CRIAMS-Centro di Medicina dello Sport dell’Università di Pavia.

Giuseppe D’Antona, MD, PhD
Medico Chirurgo, specialista in Medicina dello Sport e Dottore di Ricerca in Fisiologia è Professore Associato di Scienza dell’Esercizio fisico presso l'Università degli Studi di Pavia nonché Direttore del CRIAMS-Centro di Medicina dello Sport Voghera dove supervisiona attività clinica e di ricerca nel campo della fisiologia dell’esercizio e delle supplementazioni nutrizionali.
È autore di numerosi lavori scientifici su riviste internazionali peer reviewed, tra cui Nature e Science. Attualmente è Editor in Chief di Frontiers in Exercise Physiology e partecipa al comitato editoriale di diverse riviste internazionali.
PEER REVIEWED
NUTRIENTI & ATTIVITÀ FISICA





