SARCOPENIA:
APPROCCIO NUTRIZIONALE, ESERCIZIO FISICO E microRNA

La sarcopenia, un declino correlato all'età, della massa e della funzione del muscolo scheletrico, influisce notevolmente sulla qualità della vita. Sebbene vi sia consenso sul fatto che la sarcopenia sia una sindrome multifattoriale, l'eziologia ed i meccanismi che la causano non sono ancora stati delineati. Inoltre, la ricerca sugli interventi nutrizionali per prevenire lo sviluppo della sarcopenia si concentra principalmente sulla quantità e sulla qualità dell'assunzione di proteine. L'impatto di diverse strategie nutrizionali che considerano i tempi di assunzione di cibo, i nutrienti antinfiammatori, il controllo metabolico e il ruolo della funzione mitocondriale sulla progressione della sarcopenia non sono completamente compresi. Infine, i miRNA, in particolare quelli prodotti dal muscolo scheletrico (myomiR), potrebbero rappresentare un valido strumento per valutare la progressione della sarcopenia come potenziale biomarker per la diagnosi (1).
INTRODUZIONE
I meccanismi che sono alla base dell’instaurarsi della sarcopenia non sono ancora ben definiti. I fattori di rischio includono l'età, il sesso, il livello di attività fisica (ad esempio, l'esercizio di resistenza è particolarmente efficace per rallentare la perdita di tessuto muscoloscheletrico legata all'età) e le abitudini alimentari. Un apporto energetico e/o proteico carente contribuirà alla riduzione sia della quantità che della funzionalità del muscolo scheletrico. Inoltre, la sarcopenia è associata ad importanti comorbidità come obesità, osteoporosi, diabete di tipo II ed insulino-resistenza (2). A livello molecolare, la sarcopenia deriva da un aumento sproporzionato della degradazione proteica muscolare e/o da una diminuzione della sintesi proteica muscolare (3). Alcuni ormoni (con effetto anabolico), alcuni nutrienti e l'attività fisica sono effettori positivi del recettore tirosino-chinasico e della via fosfatidilinositolo 3-chinasi (PI3K) /Akt (4). Questa via metabolica stimola la sintesi proteica muscolare attraverso l'attivazione del mammalian target of rapamycin complex 1 (mTORC1), ma inibisce anche le vie cataboliche mediante la fosforilazione dei fattori di trascrizione forkhead box (FOXO). È ben noto che mTORC1 sia un regolatore chiave nel controllo della massa muscolare scheletrica attraverso la stimolazione della sintesi proteica, necessaria per la crescita cellulare, la proliferazione e la differenziazione (5), ma è anche implicato nella regolazione dell'autofagia generale e della mitofagia (6,7). Il processo di invecchiamento si traduce in un calo significativo di diversi ormoni anabolici. Le concentrazioni plasmatiche del fattore di crescita insulino-simile 1 (IGF-1) sono significativamente associate all’avanzare dell’età sia negli uomini che nelle donne. L'IGF-1 circolante svolge un ruolo attivo nei processi di sintesi proteica attraverso l'attivazione della via mTORC1 e nella regolazione della secrezione dell'ormone della crescita (GH) attraverso un meccanismo di feedback negativo (8). Anche gli estrogeni possono svolgere un ruolo significativo nella riparazione muscolare e nei processi rigenerativi, inclusa l'attivazione e la conseguente proliferazione delle cellule satellite (8).
EZIOPATOGENESI
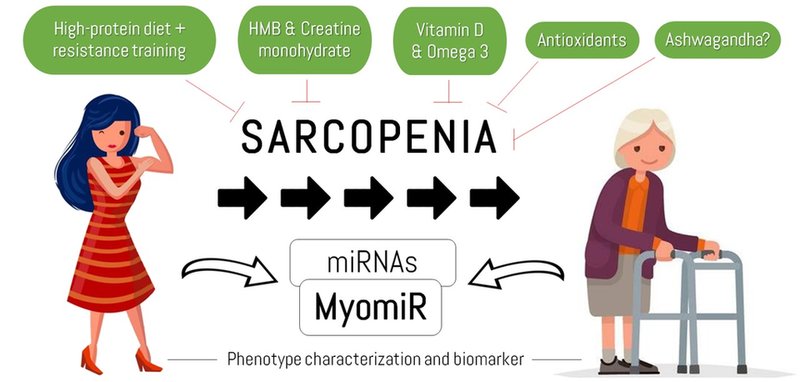
Figura 1. Graphical Abstract (1).
ERIKA CIONE1
ROBERTO CANNATARO2, 3, 4, 5
DIEGO A. BONILLA4
1. Università della Calabria | Italia
2. CEO, BlowC | Italia
3. CSO, Galascreen Laboratories | Italia
4. DBSS International SAS | Colombia
5. Membro del COMITATO SCIENTIFICO di NUTRA HORIZONS



Bio...



Erika Cione
Vive e lavora a Cosenza, è Professoressa Associato di Biochimica all’Università della Calabria e si occupa di come i fattori di crescita e i nutrienti influenzano il metabolismo.
Roberto Cannataro
Laureato in Ingegneria Chimica, Scienze e Tecnologie Alimentari e Scienza della Nutrizione Umana, opera come nutrizionista in 14 città diverse, ha collaborato e collabora con varie realtà sportive professionistiche. E' consulente per lo sviluppo di integratori alimentari dall’idea al reperimento materie prima, dall’impiantistica al customer advertising.
E' il referente nutrizione dei Ediermes e per loro dirige un Master di Nutrizione ed integrazione nello sport; all’Università della Calabria co-dirige il Master di primo livello “Sport Analytics”.
E' CSO di Galascreen Laboratories, Vita Vegan Excellence e BlowCarb.
Faccio parte di vari comitati scientifici e reviewer board.
Diego A. Bonilla
CEO e Direttore Scientifico di DBSS - Dynamical Business & Science Society. Ricercatore associato presso il Gruppo di Ricerca di Biochimica e Biologia Molecolare (Università Francisco José de Caldas), presso il gruppo di Ricerca in Attività Fisica, Sport e Scienze della Salute - GICAFS (Università di Córdoba), NUTRAL (Università CES), and Exercise and Sport Nutrition Laboratory (Texas A&M). Responsabile dell’iniziativa "Creatine For Health" sponsorizzata da Creapure® - Alzchem Group AG.
I microRNA (miRNA) sono costituiti da brevi sequenze nucleotidiche (circa 15-30 basi). Sono RNA non codificanti a filamento singolo, ma sono in grado di modulare l'espressione genica legandosi a regioni specifiche dell'mRNA, con conseguente inibizione della sintesi proteica (traduzione) e/o di modulare la degradazione dell’mRNA. Questa capacità regolatoria epigenetica li rende cruciali per il normale sviluppo di tutti gli esseri viventi (9). i miRNA sono presenti in tutti i tessuti e fluidi corporei (10). Una caratteristica importante del muscolo scheletrico è un gruppo di miRNA, identificato come myomiR (11), che sembra avere un ruolo centrale nella regolazione della plasticità del muscolo scheletrico coordinando i cambiamenti nel tipo di fibra e della massa muscolare in risposta a differenti attività. In questo senso (12) i miR-146a e miR-486 si potrebbero usare come biomarker di sarcopenia negli anziani, sarebbe anche interessante valutarli in altri fluidi biologici di più facile reperibilità (come urine e saliva); infine una possibilità intrigante è data dagli antagomir, ovvero sequenze palindromiche dei miRNA che ne bloccano l’azione, il problema, però è come far raggiungere il tessuto target.
MicroRNA
E’ noto che la sintesi proteica tende a diminuire con l’avanzare dell’età, questo è dovuto alla diminuzione dell’attività fisica, ma anche ad un minore introito di proteine nonché ad una minore efficienza della funzione intestinale, per questo si raccomanda un apporto proteico giornaliero maggiore di 1gxKg di peso corporeo (13); d’altra parte anche l’apporto energetico deve essere ben commisurato, altrimenti la sintesi proteica e l’equilibrio ne risentirebbero. Ci sono alcuni nutrienti che potrebbero essere utilizzati come integratori o in ogni caso da considerare nel complesso del piano nutrizionale.
Aminoacidi
Gli aminoacidi ramificati (BCAA) in particolare la leucina hanno una azione attivante del pathway dell’mTORC1 (14), dunque bisognerebbe garantire un apporto adeguato non solo di proteine ma di quelle ad alto valore biologico, che contengono un quantitativo adeguato di aminoacidi essenziali; i BCAA sono tre di questi otto, in particolare la leucina è capace di attivare l’mTORC1, tanto che si potrebbe pensare ad un’integrazione di 3-6g al giorno. Anche il β-idrossi-β-metilbutirrato, metabolita della leucina, potrebbe essere utile grazie all’azione anticatabolica in quanto risparmiatore di Leucina, il dosaggio potrebbe essere di 1-3 g al giorno (15).
Creatina
Ci sono molti studi che provano che la creatina, se abinata con l’esercizio di forza, favorisce l’aumento della massa muscolare negli anziani (16); questa molecola garantisce una riserva energetica per le cellule, il che si dimostra benefico anche dal punto di vista del sistema cardiovascolare, del sistema immunitario e del istema nervosa; non crea problemi né dal punto di vista renale né epatico, un dosaggio di 2-3g al giorno potrebbe essere da considerare, in quanto questo dosaggio è ritenuto sicuro per tutte le età e se utilizzato in cronico garantisce un aumento delle reserve di creatina intramuscolare (1,17,18).
Vitamina D
La popolazione anziana è particolarmente a rischio di carenza di vitamina D, anche se di fatto lo è l’intera popolazione; livelli inadeguati di vitamina D sono correlati alla perdita di massa muscolare ed alla fragilità ossea, mentre una supplementazione favorisce l’aumento di massa muscolare (19); un dosaggio di 2000UI potrebbe essere utile, magari valutandone la concentrazione plasmatica periodicamente.
Nutrienti collegati all’infiammazione ed allo stato antiossidante
L’infiammazione ha probabilmente un ruolo nella sarcopenia; in particolare se è concomitante uno stato di sovrappeso o di obesità; questo induce l’attivazione del nuclear factor kappa-light-chain-enhancer (NFkB) of activated B cells, un mediatore intracellulare fondamentale per la regolazione degli stati infiammatori; l’infiammazione, tra le varie conseguenze, evoca la produzione di radicali liberi; dunque gestire entrambi i fattori può risultare nel miglioramento della condizione di sarcopenia (20). L’apporto giornaliero di polifenoli grazie all’azione vitamino-simile, ma anche all’attivazione del nuclear factor erythroid 2–related factor 2 (Nrf2) che a sua volta attiva geni capaci di contrastare l’azione dei radicali liberi, anche regolando i miRNA; un’apporto giornaliero di 200-300mg di polifenoli sarebbe da consigliare, anche tramite agli alimenti, ricordiamo ad esempio la quercetina (mela, cipolla), il resveratrolo (uva e quindi vino), il sulforafano (tutte le crucifere), se questo apporto non viene raggiunto bisognerebbe considerare degli integratori (21).
RUOLO DELL’ALIMENTAZIONE E DEI NUTRIENTI
Probabilmente è la condizione essenziale per la gestione della sarcopenia; l’esercizio fisico dovrebbe essere alla base di qualsiasi intervento si possa utilizzare; nello specifico bisogna considerare almeno una parte con opposizione di resistenza, in modo da favorire il miglioramento della forza e l’aumento della massa muscolare. La perdita di massa muscolare con l’età può essere considerato un processo fisiologico, ma come raccomandato dall’American College of Sport Science (ACSM), una regolare attività fisica può invertire il processo di diminuzione del 3-8% annuo che si manifesta in media nella popolazione compresa tra 50 e 70 anni (22,23).
Spesso si pensa all’esercizio con i pesi come qualcosa di pericoloso, ma lo diventa solo se operato in maniera non adeguata e progressive; in effetti in alcuni nostri lavori lo abbiamo applicato con successo in casi di patologie come la spondiloartrite (24) e patologie in età avanzata come l’osteoartrite del ginocchio (25); nel caso della sarcopenia questi schemi allenanti diventano essenziali, come mostrato in una nostra recente review, si possono proporre anche schemi meno convenzinali come gli allenamenti con gli elastici (suspension training) o i cluster set in modo da avere una progressione del carico più dolce e controllata; ma anche il classico powerlifting può essere una valida alternativa, anche perchè la risposta a questo tipo di allenamenti nell’anziano è paragonabile ai soggetti più giovani; certo una componente di endurance per completare gli schemi allenanti, andrebbe considerata (26,27). Ovviamente bisogna valutare attentamente l’opportunità dell’utilizzo degli schemi allenanti e soprattutto la progressione va operata in maniera graduale e supervisionata (24,25).
RUOLO DELL’ESERCIZIO FISICO
Negli ultimi anni l’aspettativa di vita è notevolmente aumentata, dunque la popolazione potenzialmente soggetta alla sarcopenia è in aumento; come detto la stima di perdita di massa muscolare è in un range del 3-8%; i fattori scatenanti non sono ancora ben chiari, ma sicuramente la diminuzione dell’attività fisica sia per quanto riguarda la frequenza che l’intensità, è un fattore decisivo; dunque l’allenamento con opposizione di resistenza operato almeno tre volte a settimana sarebbe assolutamente da considerare, ovviamente da personalizzare; particolarmente in questo caso non si può pensare di schemi che vadano bene per tutti, anzi c’è bisogno di una supervisione continua, sia per valutare la corretta esecuzione degli esercizi ma anche per la progressione degli stessi.
Altro punto fondamentale è dato dalla dieta, che dovrebbe garantire un adeguato apporto energetico, limitare i picchi glicemici (potenzialmente infiammatori) e soprattutto un apporto proteico di almeno 1gxKg di peso corporeo, di alto valore biologico in modo da ottenere un apporto adeguato di aminoacidi essenziali; in più un apporto regolare di frutta e verdure che garantisca un quantitativo di vitamine e minerali ma soprattutto di polifenoli che garantiscono un valido aiuto nella gestione dell’infiammazione.
Infine integratori come la creatina e la vitamina D, che non potrebbero essere ottenuti dalla dieta in maniera adeguata sono sicuramente da considerare.
Per quanto riguarda la diagnosi che al momento passa da prove del cammino o di forza, quindi con dei limiti importanti, la valutazione dei miRNA, magari da saliva o urina potrebbe rappresentare una valida ed affidabile alternativa.
TAKE HOME MESSAGE
Riferimenti bibliografici
- Cannataro, R., Carbone, L., Petro, J. L., Cione, E., Vargas, S., Angulo, H., Forero, D. A., Odriozola-Martínez, A., Kreider, R. B., & Bonilla, D. A. (2021). Sarcopenia: Etiology, Nutritional Approaches, and miRNAs. International journal of molecular sciences, 22(18), 9724. https://doi.org/10.3390/ijms22189724
- Cruz-Jentoft AJ, Bahat G, Bauer J, Boirie Y, Bruyère O, Cederholm T, Cooper C, Landi F, Rolland Y, Sayer AA, Schneider SM, Sieber CC, Topinkova E, Vandewoude M, Visser M, Zamboni M; Writing Group for the European Working Group on Sarcopenia in Older People 2 (EWGSOP2), and the Extended Group for EWGSOP2. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019 Jan 1;48(1):16-31. doi: 10.1093/ageing/afy169. Erratum in: Age Ageing. 2019 Jul 1;48(4):601. PMID: 30312372; PMCID: PMC6322506 Fielding, R. A., Vellas, B., Evans, W. J., Bhasin, S., Morley, J. E., Newman, A. B., Abellan van Kan, G., Andrieu, S., Bauer, J., Breuille, D., Cederholm, T., Chandler, J., De Meynard, C., Donini, L., Harris, T., Kannt, A., Keime Guibert, F., Onder, G., Papanicolaou, D., Rolland, Y., … Zamboni, M. (2011). Sarcopenia: an undiagnosed condition in older adults. Current consensus definition: prevalence, etiology, and consequences. International working group on sarcopenia. Journal of the American Medical Directors Association, 12(4), 249–256. https://doi.org/10.1016/j.jamda.2011.01.003
- Fanzani, A., Conraads, V. M., Penna, F., & Martinet, W. (2012). Molecular and cellular mechanisms of skeletal muscle atrophy: an update. Journal of cachexia, sarcopenia and muscle, 3(3), 163–179. https://doi.org/10.1007/s13539-012-0074-6
- Laplante, M., & Sabatini, D. M. (2009). mTOR signaling at a glance. Journal of cell science, 122(Pt 20), 3589–3594. https://doi.org/10.1242/jcs.051011
- Bartolomé, A., García-Aguilar, A., Asahara, S. I., Kido, Y., Guillén, C., Pajvani, U. B., & Benito, M. (2017). MTORC1 Regulates both General Autophagy and Mitophagy Induction after Oxidative Phosphorylation Uncoupling. Molecular and cellular biology, 37(23), e00441-17. https://doi.org/10.1128/MCB.00441-17
- Crossland, H., Kazi, A. A., Lang, C. H., Timmons, J. A., Pierre, P., Wilkinson, D. J., Smith, K., Szewczyk, N. J., & Atherton, P. J. (2013). Focal adhesion kinase is required for IGF-I-mediated growth of skeletal muscle cells via a TSC2/mTOR/S6K1-associated pathway. American journal of physiology. Endocrinology and metabolism, 305(2), E183–E193. https://doi.org/10.1152/ajpendo.00541.2012
- Sandri, M., Barberi, L., Bijlsma, A. Y., Blaauw, B., Dyar, K. A., Milan, G., Mammucari, C., Meskers, C. G., Pallafacchina, G., Paoli, A., Pion, D., Roceri, M., Romanello, V., Serrano, A. L., Toniolo, L., Larsson, L., Maier, A. B., Muñoz-Cánoves, P., Musarò, A., Pende, M., … Schiaffino, S. (2013). Signalling pathways regulating muscle mass in ageing skeletal muscle: the role of the IGF1-Akt-mTOR-FoxO pathway. Biogerontology, 14(3), 303–323. https://doi.org/10.1007/s10522-013-9432-9
- Tieland, M., Trouwborst, I., & Clark, B. C. (2018). Skeletal muscle performance and ageing. Journal of cachexia, sarcopenia and muscle, 9(1), 3–19. https://doi.org/10.1002/jcsm.12238
- Moran, Y., Agron, M., Praher, D., & Technau, U. (2017). The evolutionary origin of plant and animal microRNAs. Nature ecology & evolution, 1(3), 27. https://doi.org/10.1038/s41559-016-0027
- McCall, M. N., Kim, M. S., Adil, M., Patil, A. H., Lu, Y., Mitchell, C. J., Leal-Rojas, P., Xu, J., Kumar, M., Dawson, V. L., Dawson, T. M., Baras, A. S., Rosenberg, A. Z., Arking, D. E., Burns, K. H., Pandey, A., & Halushka, M. K. (2017). Toward the human cellular microRNAome. Genome research, 27(10), 1769–1781. https://doi.org/10.1101/gr.222067.117
- Kovanda, A., Režen, T., & Rogelj, B. (2014). MicroRNA in skeletal muscle development, growth, atrophy, and disease. Wiley interdisciplinary reviews. RNA, 5(4), 509–525. https://doi.org/10.1002/wrna.1227
- Liu, H. C., Han, D. S., Hsu, C. C., & Wang, J. S. (2021). Circulating MicroRNA-486 and MicroRNA-146a serve as potential biomarkers of sarcopenia in the older adults. BMC geriatrics, 21(1), 86. https://doi.org/10.1186/s12877-021-02040-0
- Kim, J. E., O'Connor, L. E., Sands, L. P., Slebodnik, M. B., & Campbell, W. W. (2016). Effects of dietary protein intake on body composition changes after weight loss in older adults: a systematic review and meta-analysis. Nutrition reviews, 74(3), 210–224. https://doi.org/10.1093/nutrit/nuv065
- Moberg, M., Apró, W., Ekblom, B., van Hall, G., Holmberg, H. C., & Blomstrand, E. (2016). Activation of mTORC1 by leucine is potentiated by branched-chain amino acids and even more so by essential amino acids following resistance exercise. American journal of physiology. Cell physiology, 310(11), C874–C884. https://doi.org/10.1152/ajpcell.00374.2015
- Hasselgren P. O. (2014). β-Hydroxy-β-methylbutyrate (HMB) and prevention of muscle wasting. Metabolism: clinical and experimental, 63(1), 5–8. https://doi.org/10.1016/j.metabol.2013.09.015
- Candow, D. G., Forbes, S. C., Kirk, B., & Duque, G. (2021). Current Evidence and Possible Future Applications of Creatine Supplementation for Older Adults. Nutrients, 13(3), 745. https://doi.org/10.3390/nu13030745
- Bonilla, D. A., Kreider, R. B., Stout, J. R., Forero, D. A., Kerksick, C. M., Roberts, M. D., & Rawson, E. S. (2021). Metabolic Basis of Creatine in Health and Disease: A Bioinformatics-Assisted Review. Nutrients, 13(4), 1238. https://doi.org/10.3390/nu13041238
- Candow, D. G., Forbes, S. C., Kirk, B., & Duque, G. (2021). Current Evidence and Possible Future Applications of Creatine Supplementation for Older Adults. Nutrients, 13(3), 745. https://doi.org/10.3390/nu13030745
- Montero-Odasso, M., & Duque, G. (2005). Vitamin D in the aging musculoskeletal system: an authentic strength preserving hormone. Molecular aspects of medicine, 26(3), 203–219. https://doi.org/10.1016/j.mam.2005.01.005
- Dalle, S., Rossmeislova, L., & Koppo, K. (2017). The Role of Inflammation in Age-Related Sarcopenia. Frontiers in physiology, 8, 1045. https://doi.org/10.3389/fphys.2017.01045
- Cione, E., La Torre, C., Cannataro, R., Caroleo, M. C., Plastina, P., & Gallelli, L. (2019). Quercetin, Epigallocatechin Gallate, Curcumin, and Resveratrol: From Dietary Sources to Human MicroRNA Modulation. Molecules (Basel, Switzerland), 25(1), 63. https://doi.org/10.3390/molecules25010063
- Lee, S.-Y., Tung, H.-H., Liu, C.-Y., and Chen, L.-K. (2018). Physical Activity and Sarcopenia in the Geriatric Population: A Systematic Review. J Am Med Dir Assoc 19, 378–383. https://pubmed.ncbi.nlm.nih.gov/29580886/
- Chodzko-Zajko, W. J., Proctor, D. N., Fiatarone Singh, M. A., Minson, C. T., Nigg, C. R., Salem, G. J., et al. (2009). Exercise and Physical Activity for Older Adults. Medicine & Science in Sports & Exercise 41, 1510–1530. https://pubmed.ncbi.nlm.nih.gov/19516148/
- Cannataro, R., Di Maio, L., Malorgio, A., Levi Micheli, M., & Cione, E. (2021). Spondyloarthritis and Strength Training: A 4-Year Report. Journal of functional morphology and kinesiology, 6(3), 58. https://doi.org/10.3390/jfmk6030058
- Malorgio, A., Malorgio, M., Benedetti, M., Casarosa, S., & Cannataro, R. (2021). High intensity resistance training as intervention method to knee osteoarthritis. Sports medicine and health science, 3(1), 46–48. https://doi.org/10.1016/j.smhs.2021.02.005
- Cannataro, R., Cione, E., Bonilla, D. A., Cerullo, G., Angelini, F., & D'Antona, G. (2022). Strength training in elderly: An useful tool against sarcopenia. Frontiers in sports and active living, 4, 950949. https://doi.org/10.3389/fspor.2022.950949
- Ribeiro, A. S., Nunes, J. P., & Schoenfeld, B. J. (2020). Selection of Resistance Exercises for Older Individuals: The Forgotten Variable. Sports medicine (Auckland, N.Z.), 50(6), 1051–1057. https://doi.org/10.1007/s40279-020-01260-5

PEER REVIEWED
NUTRIENTI & ATTIVITÀ FISICA





