TEST DI DISSOLUZIONE:
UNO STUDIO NECESSARIO PER VALUTARE LA QUALITA’ DEI BOTANICALS?

Il mercato degli integratori è molto vasto in Italia e si stima che i botanicals rappresentino circa il 50% dei prodotti. Il controllo di qualità, quale base di garanzia della sicurezza di un derivato botanico, è generalmente correlato alla analisi mediante UV o HPLC dei fitocostituenti impiegando standards di riferimento, e alla valutazione della qualità microbiologica. A questi studi si affiancano i test di stabilità, anche di fotostabilità, generalmente intesi come stabilità chimica. In realtà, la ricerca ha evidenziato quanto sia essenziale procedere anche ad una valutazione dei parametri di tecnologica farmaceutica, impiegando saggi e procedimenti tecnologici da eseguire in maniera specifica sulle diverse forme farmaceutiche, sia convenzionali quali preparazioni solide e preparazioni liquide per uso orale così come forme di dosaggio innovative, caratterizzate da elevata specificità tecnologica, oggi molto comune nel settore farmaceutico. Di conseguenza è necessario valutare anche la stabilità delle forme farmaceutiche durante lo stoccaggio per controllare se le caratteristiche formulative rimangono costanti nel tempo. Gli studi hanno dimostrato che la formulazione e prima ancora l’estratto hanno un ruolo chiave sulla performance di un estratto con un impatto sostanziale sulla biodisponibilità dei principi attivi.
INTRODUZIONE
Le preparazioni solide per via orale, si distinguono dalle forme convenzionali o a pronto rilascio, le quali non presentano effetti sulla cessione del principio attivo e sulla solubilità in acqua e capacità di diffondere attraverso le barriere biologiche. Sono oggi disponibili anche forme farmaceutiche non convenzionali o a rilascio modificato, progettate per modulare opportunamente la cessione del principio attivo, al fine di ottenere una azione locale o sistemica, con modalità sito specifiche e temporali. Le forme convenzionali comprendono forme solide e forme liquide. In particolare, nelle forme farmaceutiche in soluzioni l’attivo già solubilizzato, pronto per essere assorbito dalla mucosa gastroenterica. Per le forme solide il processo di solubilizzazione è più complesso e nelle farmacopee sono riportati modelli in vitro per riprodurre i fenomeni che portano alla solubilizzazione degli attivi, valutando cosa accade a seguito di una somministrazione orale. Infatti, nel caso di compresse si possono valutare i processi di disintegrazione (sinonimo disaggregazione o disgregazione) e dissoluzione studiati attraverso i test di dissoluzione, quest’ultimo permette di studiare la velocità con la quale il farmaco raggiunge la circolazione sistemica. Per questo per tutte le forme di dosaggio per uso orale a rilascio immediato, quali polveri, granulati, capsule rigide e compresse, specialmente nel caso contengano sostanze poco solubili nei mezzi acquosi, necessitano come requisito lo step della dissoluzione che peraltro rappresenta il passaggio limitante l’assorbimento e la biodisponibilità sistemica (Figura 1). Nel momento in cui il farmaco viene a contatto con i fluidi biologici, questo si dissolve, creando una soluzione che attraversa il sistema gastrointestinale. L’assorbimento è quel processo attraverso il quale il principio attivo, attraversando la parete intestinale si trasferisce, in parte o totalmente, nel sistema circolatorio, e da questo viene distribuito in tutti gli organi o tessuti. Per queste formulazioni una buona prestazione è caratterizzata da un rilascio dei costituenti attivi del 75% entro 45 minuti. Per le forme orali solide non convenzionali, le specifiche di dissoluzione devono essere stabilite caso per caso. Ad esempio, per le forme gastroresistenti si richiedono delle specifiche con almeno due determinazioni, cioè una esposizione di una o due ore in mezzo acido ed il secondo ad un predefinito tempo di permanenza in un adatto tampone (di preferenza a pH 6,8). Se non diversamente indicato il valore finale del rilascio del principio attivo deve essere il 75%. Si possono anche eseguire test di dissoluzione comparativi. In questo caso i due profili sono considerati simili se la quantità totale degli attivi è ≥85% in 15 minuti, oppure c’è la necessità di una valutazione matematica a vari tempi nel caso il valore trovato sia <85% (1,2). Nel valutare l’efficacia di un attivo, sia esso farmaco o integratore, la biodisponibilità rappresenta un parametro essenziale. Questa è infatti definita come l’entità e la velocità con cui il principio attivo viene assorbito da un prodotto nel circolo sistemico. Anche se raramente dimostrata, sarebbe necessaria una correlazione piuttosto precisa tra il test di dissoluzione e la biodisponibilità di un principio attivo, in cui gioca un ruolo di primo piano, la sua dissoluzione nei due diversi fluidi quello gastrico o quello intestinale.
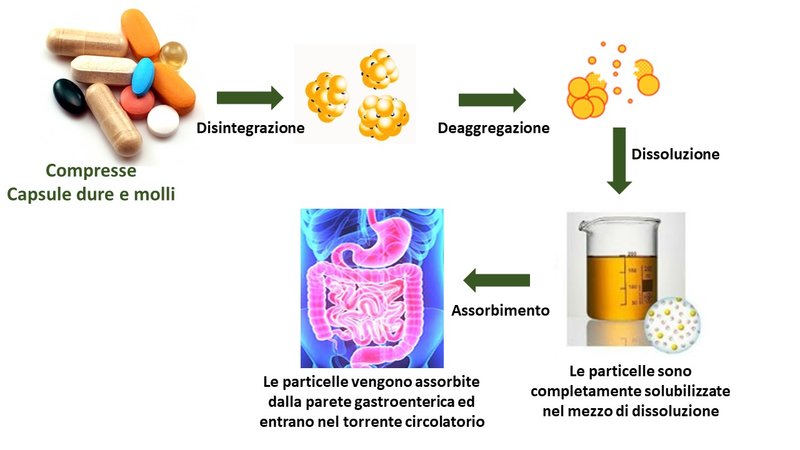
Figura 1. Processo di assorbimento delle sostanze attive da forme di dosaggio solide orali.
TEST DI DISSOLUZIONE E BIODISPONIBILITA’
Anna Rita Bilia
Laurea in Farmacia, Dottorato di ricerca in Scienze Chimiche, Specializzazione in Scienza e della Tecnologia delle piante officinali e in Farmacia Ospedaliera, Direttrice della Scuola di specializzazione in Farmacia Ospedaliera, Presidente del Centro Interdipartimentale di Servizi per le Biotecnologie di Interesse Agrario, Chimico, Industriale (CIBIACI). Vice-chair della ESCOP ed esperta della Farmacopea europea, già presidente della SIF e GA, membro gruppo lavoro IAAF della SIMef. Più di 260 pubblicazioni, editor di diversi giornali scientifici, titolare di brevetti.

DALLA LETTERATURA
Comparazione di botanicals sul mercato con simili profili qualitativi e quantitativi di costituenti attivi
Se i test di dissoluzione rappresentano analisi di routine per i farmaci di sintesi, tuttavia, nel campo dei derivati botanici, siano essi integratori o medicinali vegetali, questa proprietà cruciale generalmente non viene studiata. In uno studio riportato in letteratura, sono stati valutati e comparati i test di dissoluzione di diversi botanicals commerciali (Passiflora, Senna, Ginkgo) in forma di estratti prodotti con diversa tecnologia e di polveri micronizzate (3). I metodi e le apparecchiature utilizzate sono state quelle descritte dalla Farmacopea Europea e l’analisi è stata condotta mediante HPLC dei loro componenti attivi o costituenti marcatori. Per tutte le preparazioni sono stati ottenuti appropriati e simili comportamenti di dissoluzione dei flavonoidi del ginkgo, mentre sia per la passiflora che per la senna solo alcuni campioni hanno mostrato una completa dissoluzione dei flavoni marcatori e dei sennosidi, rispettivamente. In particolare per la passiflora è stata evidenziata una dissoluzione del 50% per un campione ed una dissoluzione prossima al 100% per altri due campioni, dopo circa 10 minuti di test (Figura 2). Nel caso della senna il profilo di dissoluzione dei sennosidi era inferiore al 10% per un campione dopo 60 minuti, mentre, dopo lo stesso periodo, un secondo campione raggiungeva circa il 90% di dissoluzione (Figura 3).
In un altro studio riportato in letteratura sono stati valutati i profili di dissoluzione dei terpeni lattonici del ginkgo proveniente da estratti commerciali presenti sul mercato tedesco. In figura 4A sono riportati i risultati ottenuti per tre prodotti: X, Y e Z. Il prodotto Y, come la maggior parte degli altri prodotti esaminati, ha rilasciato più del 75% dei componenti entro 30 min. Il prodotto X ha rilasciato quasi il 100% dei sesquiterpeni lattonici in 10 minuti, mentre il composto Z meno del 25% dopo 60 minuti, indicando una qualità farmaceutica molto eterogenea tra i campioni analizzati, che quindi non potevano essere considerati farmaceuticamente equivalenti (4).
In uno studio degli stessi autori è stata anche valutata la biodisponibilità dei principi attivi nei campioni con diverso comportamento durante il processo di dissoluzione. Dopo una singola somministrazione orale di 120 mg di estratto di ginkgo sotto forma di compresse o capsule, è stata valutata la biodisponibilità di ginkgolide A, ginkgolide B e bilobalide (Figura 4B). I risultati erano chiaramente diversi ed è stato comunque correlata una lenta dissoluzione in vitro con una bassa biodisponibilità. Questi risultati indicano che le proprietà farmaceutiche di un prodotto medicinale a base di estratti botanici hanno un impatto significativo sulla velocità e sull’entità dell’assorbimento della formulazione e di conseguenza probabilmente sull’efficacia (5).
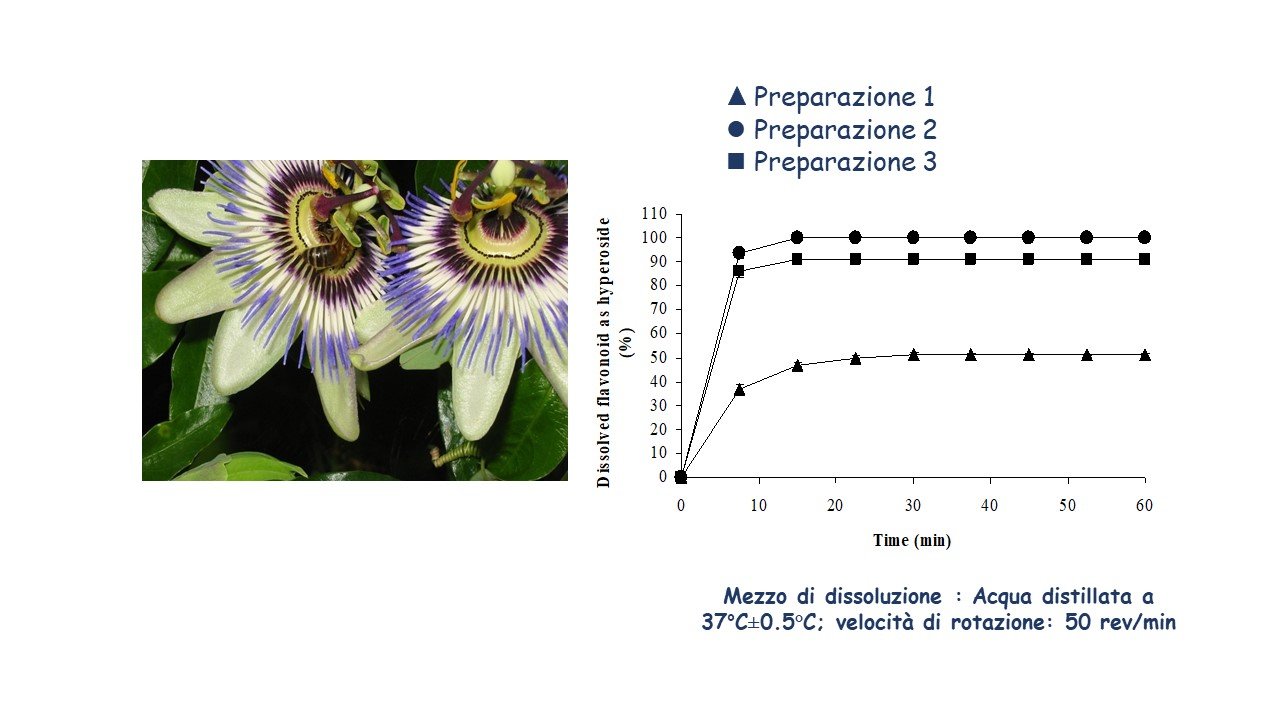
Figura 2. Profili di dissoluzione dei campioni di passiflora.

Figura 3. Profili di dissoluzione dei campioni di senna.
Progettazione di forme di dosaggio con elevata dissoluzione
Uno studio (6) ha dimostrato come la co-macinazione di un estratto di cardo mariano che contiene diversi flavolignani con due polimeri reticolati: crospovidone micronizzato (un polivinilpirrolidone di grado alimentare, PVP) e sodio carbossimetilcellulosa (CMC) in un rapporto in peso estratto-polimero 1:3 , determini un aumento dei valori di rilascio nel profilo di dissoluzione dell’estratto e dei singoli costituenti (Figura 5) grazie alla amorfizzazione dei flavolignani e ad un aumento dell’area superficiale della polvere (rispettivamente aumentata di 2.1 e 1.7 volte nei prodotti co-macinati con CMC e PVP) , per la riduzione delle dimensioni delle particelle. Questo stato attivato dell'estratto secco è rimasto stabile per un periodo di 2 anni. La cinetica di solubilizzazione è risultata migliorata sia in termini di estratto secco intero che in termini di singoli componenti. In particolare, la solubilità della silibina A era aumentata di 8 (con PVP) e 31 (con CMC) volte, mentre la silibina B aumentava di 7 (PVP) e 27 (CMC) volte ed infine la solubilità della silicristina è stata doppia nel caso della co-macinazione con sola CMC. Gli studi in vivo sui ratti hanno confermato che questo miglioramento della solubilizzazione corrispondeva ad un efficace miglioramento della biodisponibilità orale. Il massimo miglioramento della biodisponibilità è stato ottenuto con CMC, con una biodisponibilità aumentata di 88.6, 17.96 e 16.4 volte rispetto all'estratto non formulato, rispettivamente per silibina A, silibina B e silicristina (Figura 6).
In tempi più recenti diverse sono state le indagini che hanno condotto a sempre nuove formulazioni di derivati botanici per migliorare la biodisponibilità dei costituenti, fino a recenti pubblicazioni sulla possibilità di caricare in nanocarriers estratti e singoli costituenti per migliorarne la efficacia (7,8,9).

Figura 4. (A) Profili di dissoluzione tre prodotti a base di ginkgo: X, Y e Z. (B) Valutazione della biodisponibilità di ginkgolide A, ginkgolide B e bilobalide nei due prodotti X e Y messi a confronto.
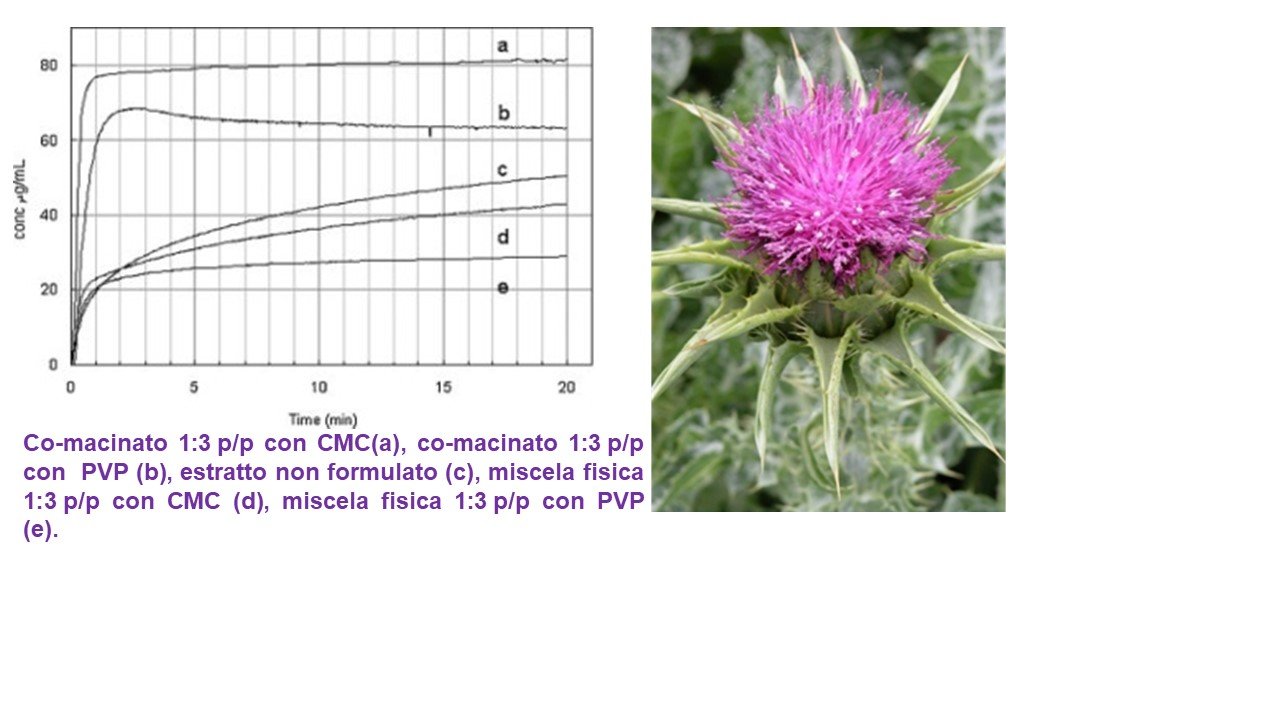
Figura 5. Effetti della co-macinazione di un estratto di cardo mariano con crospovidone micronizzato (PVP) e sodio carbossimetilcellulosa (CMC) in un rapporto in peso estratto-polimero 1:3 sul profilo di dissociazione dell’estratto.

Figura 6. Biodisponibilità dei principali costituenti dell’estratto di cardo mariano tal quale e dell’estratto co-macinato con crospovidone micronizzato (PVP) e sodio carbossimetilcellulosa (CMC) in un rapporto in peso estratto-polimero 1:3.
Gli studi dei prodotti di derivazione botanica hanno evidenziato importanti variazioni dei processi di dissoluzione legate alla produzione, alla dimensione delle particelle degli estratti secchi e alla differente composizione della formulazione. La dissoluzione nei fluidi biologici rappresenta il passaggio limitante l’assorbimento e la biodisponibilità sistemica, per cui il test di dissoluzione ha un ruolo fondamentale nello sviluppo del prodotto per identificare le variabili di processo critiche, nella fase di scale up, nel controllo di qualità e per assicurare la riproducibilità fra lotto e lotto garantendo uniformità, qualità e sicurezza del prodotto immesso sul mercato,
CONCLUSIONI
Riferimenti bibliografici
- Reflection paper on the dissolution specification for generic solid oral immediate release products with systemic action’ "(EMA/CHMP/CVMP/QWP/336031/2017) https://www.ema.europa.eu/en/documents/scientific-guideline/reflection-paper-dissolution-specification-generic-solid-oral-immediate-release-products-systemic_en.pdf
- ICH M9 Guideline on Biopharmaceutics Classification System-based Biowaivers (EMA/CHMP/ICH/493213/2018). https://www.ema.europa.eu/en/ich-m9-biopharmaceutics-classification-system-based-biowaivers-scientific-guideline
- Taglioli, V., Bilia, A.R., Ghiara, C., Mazzi, G., Mercati, V., Vincieri, F.F. (2001). Evaluation of the dissolution behaviour of some commercial herbal drugs and their preparations. Pharmazie, 56(11), 868-70. https://pubmed.ncbi.nlm.nih.gov/11817172/
- Kressmann, S., Müller, W.E., Blume, H.H. (2002). Pharmaceutical quality of different Ginkgo biloba brands, Journal of Pharmacy and Pharmacology, 54 (5), 661–669, https://doi.org/10.1211/0022357021778970
- Kressmann, S., Biber, A., Wonnemann, M., Schug, B., Blume, H.H., Müller, W.E. (2002) Influence of pharmaceutical quality on the bioavailability of active components from Ginkgo biloba preparations. Journal of Pharmacy and Pharmacology, 54(11), 1507–1514, https://doi.org/10.1211/002235702199
- Voinovich, D., Perissutti, B., Magarotto, L., Ceschia, D., Guiotto, P., Bilia, A.R. Solid state mechanochemical simultaneous activation of the constituents of the Silybum marianum phytocomplex with crosslinked polymers. J Pharm Sci. 2009 Jan;98(1):215-28. https://pubmed.ncbi.nlm.nih.gov/18428992/
- Bilia, A.R., Piazzini, V., Risaliti, L., Vanti, G., Casamonti, M., Wang, M., Bergonzi, M.C. (2019) Nanocarriers: A Successful Tool to Increase Solubility, Stability and Optimise Bioefficacy of Natural Constituents. Current Medicinal Chemistry 26(24), 4631-4656. https://pubmed.ncbi.nlm.nih.gov/30381065/
- Bilia, A.R., Piazzini, V., Guccione, C., Risaliti, L., Asprea, M., Capecchi, G., Bergonzi, M.C. (2017). Improving on Nature: The Role of Nanomedicine in the Development of Clinical Natural Drugs. Planta Medica, 83(5):366-381. https://doi.org 10.1055/s-0043-102949. https://pubmed.ncbi.nlm.nih.gov/28178749/
- Grifoni, L., Vanti, G., Donato, R., Sacco, C., Bilia, A.R. (2022). Promising Nanocarriers to Enhance Solubility and Bioavailability of Cannabidiol for a Plethora of Therapeutic Opportunities. Molecules, 27(18), 6070. https://pubmed.ncbi.nlm.nih.gov/36144803/

PEER REVIEWED
FITOTERAPICI





